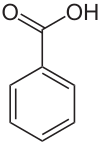
苯甲酸
苯甲酸(英语:Benzoic acid),又称安息香酸、苄酸,结构简式为C6H5COOH,是苯环上的一个氢被羧基(-COOH)取代形成的化合物。苯甲酸一般常作为药物或防腐剂使用,有抑制真菌、细菌、霉菌生长的作用,药用时通常与水杨酸合剂涂在皮肤上,用以治疗癣类的皮肤疾病。[4]可用于合成纤维、树脂、涂料、橡胶、烟草工业。
| 苯甲酸 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Benzoic acid | |||
| 系统名 Benzenecarboxylic acid | |||
| 别名 | 羧基苯、E210、苯酸、安息香酸、苯蚁酸 | ||
| 识别 | |||
| CAS号 | 65-85-0 | ||
| PubChem | 243 | ||
| ChemSpider | 238 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | WPYMKLBDIGXBTP-UHFFFAOYAD | ||
| Beilstein | 636131 | ||
| Gmelin | 2946 | ||
| 3DMet | B00053 | ||
| ChEBI | 30746 | ||
| RTECS | DG0875000 | ||
| DrugBank | DB03793 | ||
| KEGG | C00180 | ||
| MeSH | Acid benzoic Acid | ||
| 性质 | |||
| 化学式 | C6H5COOH | ||
| 摩尔质量 | 122.12 g·mol⁻¹ | ||
| 外观 | 无色透明固体 | ||
| 密度 | (固) 1.32 g/cm3 | ||
| 熔点 | 122.4 ℃ (395 K) | ||
| 沸点 | 249 ℃ (522 K) | ||
| 溶解性(水) | 1.70 g/L (0 °C) 1.80 g/L (4 °C) 2.10 g/L (10 °C) 2.90 g/L (20 °C) 3.44 g/L (25 °C) 4.20 g/L (30 °C) 6.00 g/L (40 °C) 9.50 g/L (50 °C) 12.0 g/L (60 °C) 17.7 g/L (70 °C) 27.7 g/L (80 °C) 45.5 g/L (90 °C) 68.0 g/L (95 °C)[1][2][3] | ||
| 溶解性(甲醇,乙醚) | 可溶 | ||
| pKa | 4.21 | ||
| 危险性 | |||
| 警示术语 | R:R22-R36 | ||
| 安全术语 | S:S24 | ||
| MSDS | ScienceLab.com | ||
| 主要危害 | 刺激性 | ||
| NFPA 704 | |||
| 闪点 | 121 ℃ (394 K) | ||
| 相关物质 | |||
| 相关羧酸 | 苯乙酸、马尿酸、水杨酸 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
历史
编辑苯甲酸于16世纪被发现。1556年,法国预言家诺斯特拉达姆士(Nostradamus)最早描述安息香胶的干馏作用;后由Alexius Pedemontanus和布莱斯·德·维吉尼亚分别于1560年和1596年发现。在1875年,Salkowski发现苯甲酸的抗真菌药力,于是苯甲酸用于长期保存云莓。
生产
编辑工业制备
编辑目前工业上苯甲酸主要是通过甲苯的液相,空气氧化制取的。过程是以环烷酸钴为催化剂,在反应温度为140-160℃和操作压力0.2-0.3MPa下反应生成苯甲酸。反应后蒸去甲苯,并减压蒸馏、再结晶,即得产品。该工艺利用廉价原料,收率高,因此是工业上主要使用的方法。
美国生产量预计为每一年126000吨,其中大部分是用于国内消费,以制备其他工业用化学品。
历史上的制备法
编辑首个涉及水中三氯甲苯与氢氧化钙反应的工业程序,使用铁或三氯化铁为催化剂。生成苯甲酸钙与盐酸反应即可转化为苯甲酸。该产品含有大量的氯苯甲酸衍生物。为此,供人使用的苯甲酸要由干馏安息香胶取得;即使发现其他的合成方法后,仍然禁止使用除干馏安息香胶制备法外的苯甲酸其他制法。烷基取代苯衍生给出苯甲酸。
苯甲酸也可以由干馏或用碱水水解安息香胶,苯甲醛发生坎尼扎罗反应歧化,或马尿酸水解而得。
实验室制备
编辑苯甲酸便宜又容易获得,利用苯甲酸在热水溶解度高在冷水中的溶解度低,所以可以从水中通过结晶纯化。 [5]
以苯甲醛合成
编辑苯甲醛经坎尼扎罗反应得到苯甲酸与苯甲醇,苯甲醇可通过蒸馏除去[来源请求]。
以溴苯合成
编辑溴苯加入格氏试剂,再先后与二氧化碳,并加入质子来源反应形成苯甲酸[6] [7][8]
- C6H5Br + Mg(in dry ether) → C6H5MgBr
- C6H5MgBr + CO2 → C6H5CO2MgBr
- C6H5CO2MgBr + HCl → C6H5CO2H + MgBrCl
以氯化苄合成
编辑氯化苄经由碱性的过氧化锰反应氧化形成苯甲酸:
- C6H5CH2Cl + 2 KOH + 2 [O] → C6H5COOH + KCl + H2O
反应
编辑苯甲酸发生在芳环或羧基处的反应:
芳香环反应
编辑benzoic acid aromatic ring reactions[9]
羧基是个间位定位基,因此苯环反应后,新的基团会进入羧基的间位。
羧基反应
编辑应用
编辑苯甲酸及其钠盐苯甲酸钠是很常用的食品防腐剂[10],在酸性条件下防腐性能最强。此外苯甲酸也用作农药、染料、医药、香料、媒染剂和增塑剂的生产原料,聚酰胺树脂和醇酸树脂的改性剂及钢铁设备的防锈剂等。
毒性
编辑对微生物有强烈的毒性,但其钠盐的毒性则很低。每公斤体重每日口服5毫克以下,对人体并无毒害。[11]在人体和动物组织中可与蛋白质成分的甘氨酸结合而解毒,形成马尿酸随尿排出。苯甲酸的微晶或粉尘对皮肤、眼、鼻、咽喉等有刺激作用。即使其钠盐,如果大量服用,也会对胃有损害。操作人员应穿戴防护用具。需贮存于干燥通风处,防潮、防热,远离火源。
参见
编辑参考文献
编辑- ^ 存档副本. [2014-09-25]. (原始内容存档于2014-05-23).
- ^ Seidell, Atherton; Linke, William F. [Google Books Solubilities of Inorganic and Organic Compounds] 请检查
|url=值 (帮助). Van Nostrand. 1952 [2014-05-29]. (原始内容存档于2016-03-10). - ^ Alfred D. Bacher. Recrystallization.html. University of Calfornia Department of Chemistry and Biochemistry. [2016-04-08]. (原始内容存档于2020-07-15).
- ^ 存档副本. [2021-04-22]. (原始内容存档于2021-04-22).
- ^ D. D. Perrin; W. L. F. Armarego. Purification of Laboratory Chemicals 3rd. Pergamon Press. 1988: 94. ISBN 0-08-034715-0.
- ^ Donald L. Pavia. Introduction to Organic Laboratory Techniques: A Small Scale Approach. Thomson Brooks/Cole. 2004: 312–314. ISBN 0-534-40833-8.
- ^ Shirley, D. A. The Synthesis of Ketones from Acid Halides and Organometallic Compounds of Magnesium, Zinc, and Cadmium. Org. React. 1954, 8: 28–58.
- ^ Huryn, D. M. Carbanions of Alkali and Alkaline Earth Cations: (ii) Selectivity of Carbonyl Addition Reactions. Trost, B. M.; Fleming, I. (编). Comprehensive Organic Synthesis, Volume 1: Additions to C—X π-Bonds, Part 1. Elsevier Science. 1991: 49–75. ISBN 978-0-08-052349-1.
- ^ Brewster, R. Q.; Williams, B.; Phillips, R. (1955). "3,5-Dinitrobenzoic Acid". Org. Synth.; Coll. Vol. 3: 337.
- ^ 用于食品防腐时,用量不可超过 0.1ppm,过量时会造成肝肾衰竭。
- ^ Concise International Chemical Assessment Document 26: BENZOIC ACID AND SODIUM BENZOATE. [2013-09-30]. (原始内容存档于2020-11-14).