CRISPR

CRISPR(IPA:/ˈkrɪspər/;DJ:/ˈkrispə/;KK:/ˈkrɪspɚ/)是存在于细菌中的一种基因组,该类基因组中含有曾经攻击过该细菌的病毒的基因片段。细菌透过这些基因片段来侦测并抵抗相同病毒的攻击,并摧毁其DNA。这类基因组是细菌免疫系统的关键组成部分。透过这些基因组,人类可以准确且有效地编辑生命体内的部分基因,也就是CRISPR/Cas9基因编辑技术。
CRISPR/Cas系统,为目前发现存在于多数细菌与绝大多数的古菌中的一种后天免疫系统[2],以消灭外来的质体或者噬菌体[3][4],并在自身基因组中留下外来基因片段作为“记忆”[5]。全名为常间回文重复序列丛集/常间回文重复序列丛集关联蛋白系统(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated proteins)。
目前已发现三种不同类型的 CRISPR/Cas系统,存在于大约40%和90%已定序的细菌和古菌中[6][7]。其中第二型的组成较为简单,以Cas9蛋白以及向导RNA(gRNA)为核心的组成。
Cas9是第一个被广泛应用的CRISPR核酸酶,其次是Cpf1,其在新泽西弗朗西斯菌的CRISPR/Cpf1系统中被发现[8][9]。其它这样的系统被认为存在[10]。
由于其对DNA干扰(DNAi)的特性(参见RNAi),目前被积极地应用于遗传工程中,作为基因体剪辑工具,与锌指核酸酶(ZFN)及类转录活化因子核酸酶(TALEN)同样利用非同源性末端接合(NHEJ)的机制,于基因体中产生脱氧核糖核酸的双股断裂以利剪辑。二型CRISPR/Cas并经由遗传工程的改造应用于哺乳类细胞及斑马鱼的基因体剪辑[11][12]。其设计简单以及操作容易的特性为最大的优点。未来将可应用在各种不同的模式生物当中。
| Cascade (CRISPR相关病毒防御复合体) | |
|---|---|
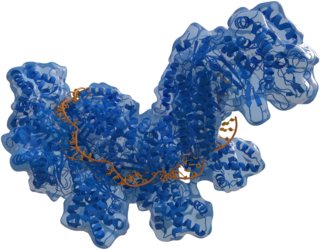
| |
| Structure of crRNA-guided E. coli Cascade complex (Cas, 蓝色) bound to single-stranded DNA (橘色). | |
| 标识 | |
| 生物 | |
| 符号 | ? |
| PDB | 4QYZ |
| 其他数据 | |
发现历史
编辑聚簇DNA重复的发现始于世界三个地区的三个独立地点。我们今天称为CRISPR的基因组重复群集,即原核生物拟核DNA链中的丛生重复序列,在1987年一份由大阪大学的石野良纯领衔的大肠杆菌研究报告中被首次描述[13]。2000年,相似的重复序列在其它真细菌和古细菌中被发现,并被命名为短间隔重复序列(Short Regularly Spaced Repeats,SRSR)[14]。2002年SRSR被重命名为CRISPR,其中一部分基因编码的蛋白为核酸酶和解旋酶,这些关联蛋白(Cas, CRISPR-associated proteins)与CRISPR组成了CRISPR/Cas系统[15]。
Cas9
编辑科学家还研究了来自化脓性链球菌的更简单的CRISPR系统,其依赖于蛋白Cas9。Cas9内切核酸酶是包含两个小RNA分子的四组分系统[16]。
詹妮弗·杜德纳、埃马纽埃尔·卡彭蒂耶及张锋各自独立的探索CRISPR关联蛋白,了解细菌如何在它们的免疫防御使用间隔(spacer)。她们共同研究一个比较简单的依赖于称为Cas9蛋白质的CRISPR系统。
Cpf1
编辑在2015年,核酸酶Cpf1被发现在新泽西弗朗西斯菌的CRISPR/Cpf1系统[8][9]。其他这样的系统被认为存在[10]。Cpf1显示了与Cas9的几个关键差异,包括:导致双链DNA中的“交错”切割,而不是由Cas9产生的“钝的”切割,依赖于“富含T碱基”的原间隔序列(Protospacer)相邻基序(为Cas9提供替代的靶向位点) 仅需要CRISPR RNA(crRNA)用于成功靶向(使用Cas9同时需要crRNA和一个反式激活的crRNA(tracrRNA))。
评价
编辑在2012年和2013年,CRISPR是《科学杂志》年度突破的第二名。在2015年,它是该奖项的赢家。CRISPR在2014年和2016年被《麻省理工科技评论》评为10项突破技术之一[17][18]。
参阅
编辑参考文献
编辑- ^ Horvath P, Barrangou R. CRISPR/Cas, the immune system of bacteria and archaea. Science. January 2010, 327 (5962): 167–70. PMID 20056882. doi:10.1126/science.1179555.
- ^ Westra ER, Swarts DC, Staals RH, Jore MM, Brouns SJ, van der Oost J. The CRISPRs, they are a-changin': how prokaryotes generate adaptive immunity. Annu Rev Genet. 2012, 46: 311–339. PMID 23145983.
- ^ Barrangou R, Fremaux C, Deveau H; et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. March 2007, 315 (5819): 1709–12. PMID 17379808. doi:10.1126/science.1138140.
- ^ Marraffini LA, Sontheimer EJ. CRISPR Interference Limits Horizontal Gene Transfer in Staphylococci by Targeting DNA. Science. December 2008, 322 (5909): 1843–5. PMC 2695655 . PMID 19095942. doi:10.1126/science.1165771.
- ^ Marraffini LA, Sontheimer EJ. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. February 2010, 11 (3): 181–190. PMC 2928866 . PMID 20125085. doi:10.1038/nrg2749.
- ^ 71/79 Archaea, 463/1008 Bacteria CRISPRdb, Date: 19.6.2010
- ^ Grissa I, Vergnaud G, Pourcel C. The CRISPRdb database and tools to display CRISPRs and to generate dictionaries of spacers and repeats. BMC Bioinformatics. 2007, 8: 172. PMC 1892036 . PMID 17521438. doi:10.1186/1471-2105-8-172.
- ^ 8.0 8.1 Zetsche B, Gootenberg JS, Abudayyeh OO, Slaymaker IM, Makarova KS, Essletzbichler P, Volz SE, Joung J, van der Oost J, Regev A, Koonin EV, Zhang F. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. October 2015, 163 (3): 759–71. PMID 26422227. doi:10.1016/j.cell.2015.09.038.
- ^ 9.0 9.1 Fonfara I, Richter H, Bratovič M, Le Rhun A, Charpentier E. The CRISPR-associated DNA-cleaving enzyme Cpf1 also processes precursor CRISPR RNA. Nature. April 2016, 532 (7600): 517–21. PMID 27096362. doi:10.1038/nature17945.
- ^ 10.0 10.1 Even CRISPR. The Economist. [2016-05-25]. ISSN 0013-0613.
- ^ Mali P, Yang L, Esvelt KM, Aach J, Guell M, Dicarlo JE, Norville JE, Church GM. RNA-Guided Human Genome Engineering via Cas9. Science. 2013. PMID 23287722.
- ^ Hwang WY, Fu Y, Reyon D, Maeder ML, Tsai SQ, Sander JD, Peterson RT, Yeh JR, Joung JK. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol. 2013. PMID 23360964. doi:10.1038/nbt.2501.
- ^ Ishino Y, Shinagawa H, Makino K, Amemura M, Nakata A. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. J Bacteriol. 1987, 169 (12): 5429–33. PMC 213968 . PMID 3316184.
- ^ Mojica FJM, Díez-Villaseñor C, Soria E, Juez G. Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria. Mol Microbiol. 2000, 36 (1): 244–6. PMID 10760181. doi:10.1046/j.1365-2958.2000.01838.x.
- ^ Jansen R, Embden JD, Gaastra W, Schouls LM. Identification of genes that are associated with DNA repeats in prokaryotes. Mol Microbiol. 2002, 43 (6): 1565–75. PMID 11952905. doi:10.1046/j.1365-2958.2002.02839.x.
- ^ Barrangou R. Diversity of CRISPR-Cas immune systems and molecular machines. Genome Biology. November 2015, 16: 247. PMC 4638107 . PMID 26549499. doi:10.1186/s13059-015-0816-9.
- ^ Talbot D. Precise Gene Editing in Plants/ 10 Breakthrough Technologies 2016. Massachusetts Institute of Technology. 2016 [18 March 2016].
- ^ Larson C, Schaffer A. Genome Editing/ 10 Breakthrough Technologies 2014. Massachusetts Institute of Technology. 2014 [18 March 2016].