羟脯胺酸
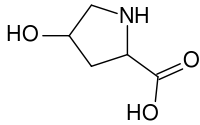
羟脯胺酸(英语:Hydroxyproline)也称作(2S,4R)-4-羟脯胺酸,或是L-羟脯胺酸(C5H9O3N),是一种常见的非标准蛋白质氨基酸,而它的缩写则是 HYP。
| 羟脯胺酸 | |
|---|---|
| |
| IUPAC名 (2S,4R)-4-hydroxypyrrolidine- 2-carboxylic acid | |
| 识别 | |
| CAS号 | 51-35-4 |
| PubChem | 825 |
| ChemSpider | 236516 |
| SMILES |
|
| InChI |
|
| InChIKey | FGMPLJWBKKVCDB-UHFFFAOYAX |
| MeSH | Hydroxyproline |
| 性质 | |
| 化学式 | C5H9NO3 |
| 摩尔质量 | 131.13 g·mol−1 g·mol⁻¹ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
结构和发现
编辑在1902年时,赫尔曼·埃米尔·费歇尔从水解明胶中分离出了羟脯胺酸。在1905年时,Hermann Leuchs合成出了4-羟基脯氨酸的外消旋混合物 [1]。 羟脯氨酸有别于脯胺酸(英语:Proline),有一个键结在 γ 碳原子上的(OH)基团存在。
合成和功能
编辑羟脯氨酸的制备是借由脯氨酸经脯氨酰羟化酶行羟基化反应后,在 γ 碳原子上键结一个(OH)基团。(此为一种转译后修饰) 脯氨酰羟化酶的催化反应发生在内质网的内腔中。 虽然羟脯氨酸并不直接被纳为蛋白,但在动物组织中发现约含有4%的羟脯氨酸,其含量高于其他七种氨基酸[2]。 羟脯氨酸是胶原蛋白的主要组成部分[3],羟脯氨酸和脯氨酸是影响了胶原蛋白稳定性的关键[4],他们促使了胶原蛋白形成螺旋状的结构[5]。在典型的胶原蛋白的 Xaa-Yaa-Gly 三元组序列中(其中Xaa与Yaa可以是任何一种氨基酸),羟基化的脯氨酸会取代 Yaa 的位置,而产生 Xaa-Hyp-Gly 这个序列,这种脯氨酸残基的修饰增加了胶原蛋白中三螺旋结构的稳定性。 最初被提出的说法是,由于水分子形成的氢键网络连接了脯氨酰羟基与主链羰基基团,而维持了稳定性[6]。 之后被指出,稳定性的增加,主要是借由立体电子效应和羟脯氨酸残基的水合所提供的额外稳定性[7]。 除了胶原蛋白以外,在哺乳动物的弹性蛋白和 Argonaute 2 中也具有与胶原蛋白相似的结构区域,其中也含有羟基脯氨酸。 有些蜗牛毒素,芋螺毒素,也含有羟脯氨酸,但是并无与胶原蛋白相似的序列存在[2]。
脯氨酸的羟基化作用已经被证实了,会促使缺氧诱导因子(HIF)中的α次单元(HIF-1α)经蛋白酶解作用后被降解。 在常氧(正常氧气条件下),EGLN1[1] (页面存档备份,存于互联网档案馆)蛋白会羟基化在 HIF-1α 的564位置上的脯氨酸, 这促使了其会被 von Hippel-Lindau tumor suppressor (pVHL)泛素化,之后便会触发蛋白酶体的作用,而遭到降解[8]。
因为这个原因,羟脯氨酸的含量也已经被用来作为一个指标,来确定胶原蛋白与明胶的量。不只在胶原蛋白中,羟脯氨酸也在一些其他的蛋白中被找到,
临床意义
编辑脯氨酸羟化与抗坏血酸(维生素C)相关。 最明显的,在人体内缺乏抗坏血酸的第一影响(牙龈和头发的问题),就是因为胶原蛋白中缺陷了羟基化的脯氨酸残基,而使胶原蛋白分子的稳定性降低,导致坏血病。
其他的羟基脯氨酸
编辑自然界中也存在著其它的羟基脯氨酸。 其中最值得注意的是 2,3-cis-、3,4-trans-和3,4-dihydroxyproline,其出现在矽藻的细胞壁[11],并且被假设具有使二氧化矽沉积的功能。 羟脯氨酸也存在于卵菌的外壁上,或与真菌相似的原生矽藻中[12]。 (2S,4S)-cis-4-羟基脯氨酸是在鹅膏菌属蘑菇的毒素环肽中发现。(例如,α-鹅膏蕈碱和鬼笔环肽(phalloidin))[13]
延伸阅读
编辑参考文献
编辑- ^ R.H.A. Plimmer. R.H.A. Plimmer & F.G. Hopkins , 编. The chemical composition of the proteins. Monographs on biochemistry. Part I. Analysis 2nd. London: Longmans, Green and Co. 1912: 132 [1908] [January 18, 2010].
- ^ 2.0 2.1 Gorres, Kelly L.; Raines, Ronald T. Prolyl 4-hydroxylase. Critical Reviews in Biochemistry and Molecular Biology. April 2010, 45 (2): 106–124. PMC 2841224 . PMID 20199358. doi:10.3109/10409231003627991.
- ^ Szpak, Paul. Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis. Journal of Archaeological Science. 2011, 38 (12): 3358–3372 [2014-06-10]. doi:10.1016/j.jas.2011.07.022. (原始内容存档于2012-01-18).
- ^ Nelson, D. L. and Cox, M. M. (2005) Lehninger's Principles of Biochemistry, 4th Edition, W. H. Freeman and Company, New York.
- ^ Brinckmann, J., Notbohm, H. and Müller, P.K. (2005) Collagen, Topics in Current Chemistry 247, Springer, Berlin.
- ^ Bella, J; Eaton, M; Brodsky, B; Berman, HM. Crystal and molecular structure of a collagen-like peptide at 1.9 A resolution. Science. 1994, 266 (5182): 75–81. PMID 7695699. doi:10.1126/science.7695699.
- ^ Kotch, F.W.; Guzei, I.A.; Raines, R.T. Stabilization of the Collagen Triple Helix by O-Methylation of Hydroxyproline Residues. Journal of the American Chemical Society. 2008, 130 (10): 2952–2953. PMC 2802593 . PMID 18271593. doi:10.1021/ja800225k.
- ^ Jaakkola, P.; Mole, D.R.; Tian, Y.M.; Wilson, M.I.; Gielbert, J.; Gaskell, S.J.; Kriegsheim, A.V.; Hebestreit, H.F.; et al. Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science. 2001, 292 (5516): 468–72. PMID 11292861. doi:10.1126/science.1059796.
- ^ Annu. Rev. Plant Physiol. Plant Mol. Biol. 1998. 49:281–309 PLANT CELL WALL PROTEINS Gladys I. Cassab
- ^ 存档副本. [2014-06-10]. (原始内容存档于2014-08-19).
- ^ Nakajima, T.; Volcani, B.E. 3,4-Dihydroxyproline: a new amino acid in diatom cell walls. Science. 1969, 164 (3886): 1400–1401. PMID 5783709. doi:10.1126/science.164.3886.1400.
- ^ Alexopoulos, C.J., Mims C.W. and Blackwell, M. Introductory Mycology 4th. New York: John Wiley & Sons. 1996: 687–688. ISBN 0-471-52229-5.
- ^ Wieland, T. Peptides of Poisonous Amanita Mushrooms. Springer. 1986.