吡啶氯鉻酸鹽
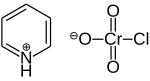
吡啶氯鉻酸鹽,分子式C5H4N·HCrO3Cl,簡稱PCC,即pyridinium chlorochromate的縮寫。一種溫和的氧化劑,橙黃色晶體。用來把醇有限度地氧化為醛,使用PCC的缺點為反應時間太過冗長和PCC具有毒性。
| 吡啶氯鉻酸鹽 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 Pyridinium chlorochromate | |||
| 別名 | PCC | ||
| 識別 | |||
| CAS號 | 26299-14-9 | ||
| ChemSpider | 10608386 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | LEHBURLTIWGHEM-YOEUSAHMAN | ||
| 性質 | |||
| 化學式 | C5H5NHClCrO3 | ||
| 摩爾質量 | 215.56 g·mol⁻¹ | ||
| 外觀 | 橙黃色結晶粉末[1] | ||
| 熔點 | 205 °C | ||
| 溶解性(其它溶劑) | 溶於二氯甲烷、 苯、乙醚、 丙酮、乙腈、 四氫呋喃 | ||
| 危險性 | |||
| 警示術語 | R:R49-R8-R43-R50/53 | ||
| 安全術語 | S:S53-S45-S60-S61 | ||
| MSDS | external MSDS sheet[永久失效連結] | ||
| 主要危害 | 氧化性、有毒、易燃 致癌、刺激性 | ||
| NFPA 704 | |||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||

由美國化學家艾里亞斯·詹姆斯·科里發明。試劑本身呈弱酸性,所以常跟緩衝劑比如乙酸鈉配合使用。
製備與結構
編輯最初始的製備方法是個偶然的發現,它由吡啶加入冷的三氧化鉻濃鹽酸溶液製備:[2]
- C5H5N + HCl + CrO3 → [C5H5NH][CrO3Cl]
這個化合物由吡啶陽離子([C5H5NH+])和結構為四面體的三氯化鉻陰離子(CrO3Cl-)所組成。實驗可得之相關鹽類,例如:1-丁基吡啶三氧化鉻([C5H5N(C4H9)]+[CrO3Cl]−)。
性質及應用
編輯醇的氧化
編輯PCC為一個氧化劑,特別在在氧化一級醇和二級醇成醛和酮的反應中具有高效率。不像相關的瓊斯試劑,PCC鮮少有過氧化的發生而形成羧酸。一個典型的PCC氧化反應為加入醇於二氯甲烷中的PCC懸浮液,簡單的反應機制:
- C5H5NHCrO3Cl + R2CHOH → C5H5NHCl + H2CrO3 + R2C=O
在實際操作過程中,鉻的副產物會與吡啶一起沉澱。可加入惰性吸附劑,如分子篩或硅膠,使得黏稠的副產物吸附至表面並更好作用。
其他反應
編輯除了簡單的羥基氧化反應外,重排反應也是可行的。例如:三級醇不能直接被氧化,但在Babler 氧化反應中,鉻酸酯的形成與PCC和烯丙基的三級醇可在碳基成型的氧化步驟前,透過 [3,3]-σ遷移反應來進行異構化。其他常見的氧化劑通常可促使簡單的脫水反應,而不能在三級羥基為中心的狀況下,發生任何氧化反應。
另一個PCC的氧化反應為不飽和的醇或醛轉變成環己烯酮的反應。這個方法為氧化陽離子的環化反應,將(-)-香茅醇轉換為(-)-胡薄荷酮。PCC也會影響烯丙基的氧化反應,如二氫呋喃(Dihydrofuran)轉變成內酯。
相關試劑
編輯其他可用於醇氧化反應之更方便且少毒性試劑包含二甲基亞碸為底的氧化反應(如斯文氧化反應、普菲茨納-莫法特氧化反應)和以高價碘為底的氧化反應(如戴斯-馬丁氧化劑)。
參考文獻
編輯- ^ Piancatelli, G.; Luzzio, F. A. (2007). "Pyridinium Chlorochromate". e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/9780470842898.rp288.pub2.
- ^ Corey, E. J.; Suggs, J. W. (1975). "Pyridinium Chlorochromate. An Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds".Tetrahedron Lett. 16 (31): 2647–2650.doi:10.1016/S0040-4039(00)75204-X.


