五氧化二磷
化合物
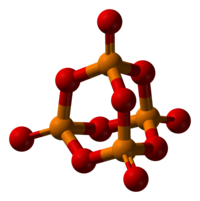
五氧化二磷(實驗式:P2O5,分子式:P4O10),磷在空氣中燃燒生成的磷氧化物。它吸水性強、並有極強的脫水性,甚至可以將濃硫酸脫水,生成三氧化硫。極易潮解,是一種強力乾燥劑。它與冷水生成偏磷酸,與熱水主要生成正磷酸。
| 五氧化二磷 | |
|---|---|

| |
| |
| 別名 | 氧化磷(V) 磷酸酐 |
| 識別 | |
| CAS號 | 1314-56-3 16752-60-6((P4O10)) |
| PubChem | 14812 |
| ChemSpider | 14128 |
| SMILES |
|
| ChEBI | 37376 |
| RTECS | TH3945000 |
| 性質 | |
| 化學式 | P4O10 |
| 摩爾質量 | 283.889 g·mol⁻¹ |
| 外觀 | 白色粉末 吸水性 刺激性氣味 |
| 密度 | 2.39 g/cm3 |
| 熔點 | 569 °C |
| 沸點 | 360 °C (昇華) |
| 溶解性(水) | 水解 |
| 蒸氣壓 | 1 mmHg, 384 °C |
| 危險性 | |
| 歐盟分類 | 未列明 |
| 主要危害 | 強烈脫水性 (或吸水性) |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
用途
編輯用於制高純高磷酸、有機合成以及氣體的乾燥劑,或用於製備多聚磷酸。
五氧化二磷是效果很好的脫水劑,因為它的水合過程是放熱的:
不過其脫水產物為一層粘稠的液體,容易覆蓋在未反應的五氧化二磷表面,導致其脫水能力下降。通常在乾燥器中使用的是五氧化二磷的顆粒。
五氧化二磷的乾燥性能很強,因而有機合成中常用它作脫水劑。其中最重要的用途是將酰胺轉變為腈類:[1]
其中P4O9(OH)2只是用來理想化地表示P4O10的脫水產物。
五氧化二磷溶於DMSO中得到的溶液稱為Onodera試劑,能夠發生斯文氧化反應,將醇氧化為醛[3]。
五氧化二磷還可以將許多無機酸轉變為對應的酸酐。例如:HNO3轉變為N2O5、H2SO4轉變為SO3、HClO4轉變為Cl2O7、HCF3SO3轉變為(CF3)2S2O5。
製備
編輯安全
編輯它與水的反應劇烈,對水含物質,如木材或棉花,會釋放大量的熱,甚至引起火災。對金屬有腐蝕性。即使在低至濃度為1毫克/米3,對人還是可能導致嚴重燒傷眼睛,皮膚,粘膜和呼吸道。
參見
編輯參考資料
編輯- ^ Meier, M. S. "Phosphorus(V) Oxide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- ^ Joseph C. Salamone (編). Polymeric materials encyclopedia: C, Volume 2. CRC Press. 1996: 1417. ISBN 0-8493-2470-X.
- ^ Tidwell, T. T. "Dimethyl Sulfoxide–Phosphorus Pentoxide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- ^ Threlfall, Richard E., (1951). The story of 100 years of Phosphorus Making: 1851 - 1951. Oldbury: Albright & Wilson Ltd
