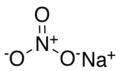硝酸鈉
化合物
此條目需要補充更多來源。 (2013年6月) |
硝酸鈉為無機鹽的一種,化學式為NaNO3,白色固體粉末,又稱為智利硝石或祕魯硝石(較不常見)其水溶液呈中性,pH約6.7~7.3。世上最大的硝酸鈉礦位於智利阿塔卡馬沙漠。
| 硝酸鈉 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Sodium nitrate | |||
| 別名 | Caliche 智利硝石 Nitrate of soda Nitratine 祕魯硝石 Soda niter cubic niter | ||
| 識別 | |||
| CAS號 | 7631-99-4 | ||
| PubChem | 24268 | ||
| ChemSpider | 22688 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | VWDWKYIASSYTQR-UHFFFAOYAL | ||
| UN編號 | 1498 | ||
| RTECS | WC5600000 | ||
| 性質 | |||
| 化學式 | NaNO3 | ||
| 摩爾質量 | 84.9947 g·mol⁻¹ | ||
| 外觀 | 白色粉末或者無色晶體 | ||
| 氣味 | 甜 | ||
| 密度 | 2.257 g/cm3, 固體 | ||
| 沸點 | 380 °C, 分解 | ||
| 溶解性(水) | 73 g/100 mL (0°C) 91.2 g/100 mL (25 °C) 180 g/100 mL (100 °C) | ||
| 溶解性 | 易溶於氨; 溶於酒精 | ||
| 折光度n D |
1.587 (三方晶系trigonal) 1.336 rhomobohedral | ||
| 結構 | |||
| 晶體結構 | 三方晶系(trigonal)和rhombohedral | ||
| 熱力學 | |||
| ΔfHm⦵298K | −467 kJ·mol−1[1] | ||
| S⦵298K | 116 J·mol−1·K−1[1] | ||
| 危險性 | |||
| MSDS | ICSC 0185 | ||
| 歐盟編號 | Not listed | ||
| 主要危害 | Oxidant, irritant | ||
| NFPA 704 | |||
| 閃點 | 不可燃 | ||
| 致死量或濃度: | |||
LD50(中位劑量)
|
3236 mg/kg | ||
| 相關物質 | |||
| 其他陰離子 | 亞硝酸鈉 | ||
| 其他陽離子 | 硝酸鋰 硝酸鉀 硝酸銣 硝酸銫 | ||
| 相關化學品 | 硫酸鈉 氯化鈉 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
可由下列化學式合成:
- NaOH(aq) + HNO3(aq) → NaNO3(aq) + H2O(l)
硝酸鈉具有氧化性,可與鉛共熱反應產生亞硝酸鈉和氧化鉛[4]。還在常溫下將氫碘酸氧化成碘單質並形成一氧化氮:
- 2NaNO3 + 8HI = 2NaI + 3I2 + 2NO↑ + 4H2O [5]
- 4NaNO3 + 4H2SO4 →(加熱)4NaHSO4 + 4NO2↑ + O2↑ + 2H2O
- NaNO3(aq) + 3FeCl2 + 4HCl →(加熱) NaCl+ 3FeCl3 + NO↑ + 2H2O[5]
將硝酸鈉與氧化鈉置於銀坩堝中以700°C加熱,大約7天後,會生成白色晶體原硝酸鈉(Na3NO4),它對水蒸氣及二氧化碳十分敏感。
硝酸鈉為醃製鹽的成分之一。
參考來源
編輯- ^ 1.0 1.1 Zumdahl, Steven S. Chemical Principles 6th Ed.. Houghton Mifflin Company. 2009: A23. ISBN 0-618-94690-X.
- ^ 中學教師化學手冊(1981 科學普及出版社)3.5無機化合物的物理常數.P154,411
- ^ R.C.Weast, Handbook of Chemistry and Physics,60thed.,1979-1980
- ^ 中學教師化學手冊(1981 科學普及出版社)6.2.20氮及其化合物的反應.P411
- ^ 5.0 5.1 中學教師化學手冊(1981 科學普及出版社)6.2.20氮及其化合物的反應.P412