基底核
此條目需要補充更多來源。 (2013年6月21日) |
基底核(英語:basal ganglia)又稱基底節、基底神經節,是大腦深部一系列神經核團組成的功能整體。它是位於大腦皮質底下一群運動神經核的統稱,[1]與大腦皮層,丘腦和腦幹相連。目前所知其主要功能為自主運動的控制、整合調節細緻的意識活動和運動反應。它同時還參與記憶,情感和獎勵學習等高級認知功能。基底核的病變可導致多種運動和認知障礙,包括帕金森氏症和亨廷頓氏症等。
| 基底核 | |
|---|---|
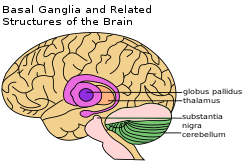 右上方有標示出基底核 | |
 從腦的冠狀切面觀察基底核 | |
| 基本資訊 | |
| 屬於 | 大腦 |
| 標識字符 | |
| 拉丁文 | nuclei basales |
| MeSH | D001479 |
| NeuroNames | 224, 2677 |
| NeuroLex ID | birnlex_826 |
| TA98 | A14.1.09.501 |
| TA2 | 5559 |
| FMA | FMA:84013 |
| 《神經解剖學術語》 [在維基數據上編輯] | |
命名
編輯基底核的英文學名為「basal ganglia」,basal(基底)意表起解剖位置位於大腦的深部和底部,而 ganglia(神經節)是一命名錯誤。Ganglia 一詞本義指周邊神經系統的神經元胞體的聚集部,但實際上基底核位於中樞神經系統。中樞神經系統的神經元胞體聚集應稱為「核」(nucleus),例如紅核。這個英文的錯誤命名一直沿用至今,成為習慣[2]。但是中文術語「基底核」卻糾正了這個錯誤。
研究歷史
編輯英國解剖學家托馬斯·威利斯(Thomas Willis)於1664年最早記載了基底核的結構。 [3] 之後許多年,「紋狀體」(Corpus striatum)一詞被用來泛指皮層下的一系列核團。 但是後來發現,其中許多核團之間並沒有直接的聯繫。比如殼核(Putamen)和尾狀核(Caudate nucleus)之間就沒有直接的連接。 今日的「紋狀體」(Striatum)一詞指尾狀核,殼核和伏隔核三者構成的整體,該整體是基底核系統的主要輸入通道。該命名法則是Cécile and Oskar Vogt (1941) 提出的。 紋狀體得名於其多紋的外形。該外形來自於大量緻密的紋狀體-蒼白球-黑質(紋蒼黑)纖維。這些纖維連接構成了基底核神經迴路的核心。紋蒼黑纖維在跨過內囊的部分也叫做「Edinger梳狀束」。 蒼白球(Globus pallidus)在早些時候被稱為豆狀核(Lentiform nucleus)。
Luys於1865年發現了丘腦下核(Subthalamic nucleus)。晚些時候,人們發現大腦腳-腦橋複合體(Pedunculopontine complex)和中央複合體(Central complex)可能調控基底核的功能。20世紀的醫學和神經生物學研究並且從初步從機理上認識了基底核的損傷和一些列運動疾病(例如帕金森氏症和亨廷頓氏症)的關聯,並且澄清了基底核參與運動和認知功能。
解剖構造
編輯如圖所示,靈長目的基底核的主要組成部分如下:
前側
- 紋狀體(Striatum)包括
後側,以下這些結構在大腦中更靠下,靠後。
- 丘腦下核(Subthalamic nucleus, STN)
- 黑質(Substantia nigra, SN),根據內部結構可分為
- 黑質緻密部(Substantia nigra pars compacta,SNc)
- 黑質網狀部(Substantia nigra pars reticulata,SNr)
- 黑質側部(Substantia nigra pars lateralis,SNl)
應注意不同學者經常賦予基底核不同的範圍。例如,並非所有學者主張將黑質算作基底核的一部分。也有一些學者主張將杏仁核劃入基底核。 哺乳類的大腦包含左右兩側的一對基底核,關於大腦中線對稱。 基底核可以從功能上劃分為一系列並行迴路,包括骨骼肌肉運動迴路,邊緣迴路和動眼迴路等。不同的迴路投射到不同的目標區。例如骨骼肌肉運動迴路主要投射到丘腦的腹外側核(Ventrolateral nucleus, VL)。
迴路和神經遞質
編輯左圖所示為基底核的基本內部連接。紋狀體(包括尾狀核和殼)是基底核系統的主要輸入通道。大腦皮層的諸多運動,前額葉和感覺分區投射到紋狀體。如表2所示,基底核中不同核團的神經元合成不同的神經遞質。穀氨酸是一種興奮性神經遞質,GABA是一種抑制性神經遞質。而如下表所示,多巴胺的興奮或抑制取決於受體的種類。來自黑質緻密部的多巴胺能輸入刺激紋狀體內的所有多巴胺受體,但是由於間接和直接通路內的受體種類不同,多巴胺輸入的效應也不同。從下表中可以看出,由於多巴胺輸入對直接通路的效應是興奮,而對間接通路的效應是抑制,該神經遞質的總體功能是活化丘腦。 [4]
基底核包含兩大迴路,分別成為直接通路(Direct pathway)和間接通路(Indirect pathway)。它們是皮質-基底核-丘腦迴路(Cortico-basal-thalamic loop)的兩大部分。
表1,基底核的直接與間接通路
| 通路名稱 | 通路的組成 (+表興奮性輸出, -表抑制性輸出 |
抑制性連接的個數 | 機能描述 | 多巴胺受體類型 |
| 直接 | 大腦皮質+ →紋狀體- →內蒼白球/黑質(GPi/SNr)- →丘腦+ →大腦皮質 |
2 (偶) | 大腦皮質的活動活化紋狀體神經元,進而抑制內蒼白球的自發發放。由於蒼白球的神經元對丘腦的作用是抑制性的,這一效應實際上削弱了丘腦所受到的抑制性輸入。這一過程成為「去抑制」(Disinhibition) | D1 (興奮性) |
| 間接 | 大腦皮質+ →紋狀體- →外蒼白球(GPe) - →丘腦下核(STN) + →內蒼白球/黑質(GPi/SNr)- →丘腦+ →大腦皮質 |
3 (奇) | 與直接通路不同,由於間接通路中抑制性突觸的個數為奇數,紋狀體神經元細胞的活化對丘腦產生抑制效應。 | D2 (抑制性) |
表2,基底核的神經遞質
| 核團 | 神經遞質 | 描述 | 相關疾病 |
| 紋狀體 | GABA | 紋狀體的輸出神經元是GABA能,抑制性的。 | 亨廷頓氏症。 |
| 黑質 | 多巴胺 | 黑質緻密部的神經元向紋狀體發出多巴胺能投射。其效應取決於受體種類。 | 若黑質緻密部細胞的多巴胺合成受阻,紋狀體受到的多巴胺能輸入的降低會導致運動和認知障礙。最典型的例子是帕金森氏症。 |
| 蒼白球 | GABA | 蒼白球包括內外兩大部分。內蒼白球直接投射到丘腦,而外蒼白球直接投射到丘腦下核。兩者的作用都是抑制性的。 | 妥瑞氏綜合症(Tourette's syndrome),亦稱抽動穢語綜合症。 |
| 丘腦下核 | 穀氨酸 | 丘腦下核的神經元通過穀氨酸能投射來興奮內蒼白球細胞。這是間接通路的一部分 |
細胞類型和突觸連接
編輯人類的紋狀體中大約有一億神經元。70%以上為輸出神經元。這些輸出神經元在其樹突上分佈有非常緻密的棘頭(Spine),故稱為棘狀神經元。 這些棘頭是棘狀神經元與傳入紋狀體的軸突形成突觸的部位。輸入紋狀體的軸突主要來自大腦皮層,丘腦和杏仁體。 這些軸突進入紋狀體後,展出覆蓋範圍甚大的側枝,與大量紋狀體神經元形成突觸。反過來,每個紋狀體神經元也和大量的輸入軸突形成突觸。據估計,每個棘狀神經元接受來自7500-15000個不同軸突的輸入。 這種連接模式類似於小腦的平行纖維和普肯野細胞(Purkinje cells)的連接模式。它可能類似於一種電子電路中的組合邏輯。 輸入到紋狀體棘狀神經元的纖維(即軸突)大多為興奮性的。但是這些神經元大多數時候卻處在靜息狀態(即不發放動作電位)的狀態。 棘狀神經元的這種活動模式,如果考慮到其收到的興奮性輸入的個數,則相當難以理解。其機制目前尚在研究中。 [6]
紋狀體中其餘的神經元為中間神經元(Interneurons),這些神經元都為抑制性,包括膽鹼能神經元,GABA/Parvalbumin神經元和Somatostasin/NOS神經元等。這些抑制性中線神經元也接受來自大腦皮質,丘腦和杏仁體的輸入,並且和紋狀體的棘狀神經元相互形成突觸連接。
在人類及其他靈長目動物中,紋狀體中有明顯的「鑲嵌」(Mosaic)結構。在該鑲嵌結構中,紋狀體內有神經元密度較高的區域,稱為「紋狀小體」(Striasome),以及將這些紋狀小體隔開的「基質」(Matrix)。紋狀體的傳入纖維在很大程度上遵守基質所劃定的界限。而且紋狀小體和基質中的神經元似乎也投射到黑質的不同部位。所以紋狀小體和基質似乎在紋狀體中形成了兩個並行的通路,其功能重要性尚在研究中。該並行通路不應與前面所講的直接和間接通路混淆。[6]
紋狀體棘狀神經元向蒼白球和黑質發出GABA能抑制性輸出。據估計,蒼白球大約只有70萬神經元,比紋狀體神經元的數量少兩個數量級。這就意味着平均來說,每個蒼白球神經元接受來自100個左右紋狀體神經元的抑制性輸入。
蒼白球和黑質的輸出神經元在大多數時候處在自發發放狀態,這可能與這些細胞的膜特性有關。它們投射到丘腦腹外側核以及上丘,其自發持續發放抑制其中的細胞。但是一旦紋狀體內的特定棘狀神經元被活化,這些蒼白球/黑質神經元將受到強有力的抑制,從而暫停發放。這一過程釋放了蒼白球對丘腦腹外核的抑制,使一個動作得以啟動。
與基底核功能相關的疾病 : 基底核的病變可導致多種運動和認知障礙,如 帕金森氏症、亨丁頓舞蹈症、半側投擲症、妥瑞氏綜合症、肌肉張力失常、 痙攣性失聲症、口吃。
學者已經在猴子等動物進行了一系列在體(In vivo)電生理研究。在動物體內,棘狀神經元多數時候靜息,只偶爾發放若干個脈衝,且持續時間不超過3秒,發放率不超過40脈衝/秒。這些脈衝一般與動物的特定動作的起始同步。另一些實驗觀察到了動物在啟動響應性動作(例如動眼)時黑質細胞的暫停發放 [7] [8]。 這種對應於特定感覺指導下的動作的基底核神經元發放模式是隨着動作的學習逐漸產生的 [9]。 另外,有趣的是,一項研究表明:許多黑質細胞自發發放的暫停,只發生在依賴與外界感覺信號的,學習到的動作,而不發生在自發的動作,即使這兩個是同一個動作 [10]。
功能
編輯眼球運動
編輯基底神經節的一項受到深入研究的功能是它在控制眼球運動中的作用。[11]眼球運動受到廣泛的大腦區域網絡的影響,該網絡集中在稱為上丘的中腦區域。上丘是一種分層結構,其層形成視覺空間的二維視網膜圖。上丘深層神經活動的「碰撞」驅動眼球運動指向空間中的相應點。
上丘接收來自基底神經節的強烈抑制性投射,起源於黑質網狀部。黑質網狀部中的神經元通常以高速率連續發射,但在眼球運動開始時它們「暫停」,從而使上丘擺脫抑制。所有類型的眼球運動都與信噪比中的「暫停」有關;然而,單個黑質網狀部神經元可能與某些類型的運動比其他類型的運動更密切相關。尾狀核某些部分的神經元也表現出與眼球運動相關的活動。由於絕大多數尾狀細胞以非常低的速率發射,因此這種活動幾乎總是表現為發射速率的增加。因此,眼球運動從尾狀核的活化開始,尾狀核通過直接的 GABA 能投射抑制信噪比,進而抑制上丘。
在積極性中的作用
編輯基底神經節中的細胞外多巴胺與齧齒動物的積極性有關,高水平與飽足的「欣快感」有關,中等水平與尋求有關,低水平與厭惡有關。邊緣基底神經節迴路受到細胞外多巴胺的嚴重影響。增加的多巴胺導致腹側蒼白球、內足核和黑質網狀部的抑制,導致丘腦去抑制。這種直接 D1 和間接 D2 通路的模型解釋了為什麼每個受體的選擇性促效劑沒有回報,因為去抑制需要兩種通路的活性。丘腦的去抑制導致前額葉皮層和腹側紋狀體的活化,選擇性地增加 D1 活動導致獎勵。[12]還有來自非人類靈長類動物和人類電生理學研究的證據表明,包括蒼白球內部和丘腦底核在內的其他基底神經節結構也參與了獎賞處理。[13][14]
做決定
編輯研究人員已經為基底神經節提出了兩種模型,一種是由腹側紋狀體中的「批評者」產生並估計值的動作,以及由背側紋狀體中的「執行者」執行的動作。另一種模型提出基底神經節作為一種選擇機制,其中動作在皮層中生成,並由基底神經節根據上下文進行選擇。[15]CBGTC 循環也涉及獎勵折扣,隨着意外或高於預期的獎勵而增加。[16]一篇綜述支持這樣一種觀點,即無論結果如何,皮層都參與學習行動,而基底神經節則參與基於基於聯想獎勵的試錯學習來選擇適當的行動。[17]
工作記憶
編輯有人提出,基底神經節可以控制進入和不進入工作記憶的內容。一個假說提出直接通路(Go 或興奮性)允許資訊進入前額皮質,在那裏它保持獨立於通路;另一種理論認為,為了使資訊留在前額皮質中,直接通路需要繼續反射。有人提出,短的間接通路是與直接通路相拮抗的,可以關閉通向前額皮質的門。這些機制共同調節工作記憶焦點。[18]
與基底核功能相關的疾病
編輯如上文所述,帕金森氏症,表現為運動遲緩,運動喪失和靜止性震顫等症狀,主要是由於黑質緻密部的退化和隨後的多巴胺能輸出降低有關。多巴胺的減少造成了紋狀體直接通路的抑制和間接通路的去抑制,進而導致基底核對丘腦的興奮的喪失。與帕金森氏症幾乎相對的一種疾病成為亨廷頓氏症(Huntington's disease),表現為異常的多餘動作(舞蹈性震顫)以及協調缺乏等症狀,是由於紋狀體和蒼白球的退化造成的。半側投擲症(Hemiballism),表現為反覆的上肢運動(如投擲棒球),是由於丘腦下核(subthalamus)的退化或損傷。丘腦下核作為間接通路的最後一級,其到興奮內蒼白球的作用。這種興奮的確實導致內蒼白球對丘腦的抑制作用減弱,進而導致了半側投擲症中所見的冗餘動作(多動症)[5]。妥瑞氏綜合症,表現為運動痙攣,注意力問題和口出穢語等症狀,也被認為與基底核的興奮和抑制作用的平衡喪失有關 [19]。 目前被認為可能與基底核功能相關的疾病還包括張力失常(dystonia) [20] [21], 痙攣性失聲症和口吃 [22] 等。
參見
編輯參考文獻
編輯- ^ 成人內外科護理學
- ^ Soltanzadeh, Akbar. Neurologic Disorers. Tehran: Jafari. 2004. ISBN 964-6088-03-1.
- ^ Andrew Gilies, A brief history of the basal ganglia (頁面存檔備份,存於互聯網檔案館), retrieved on 27 June 2005
- ^ Delong, M. The basal ganglia. E. R. Kandel, J. H. Schwartz, & T. M. Jessell (編). Principles of Neural Science 4th edition. New York: McGraw-Hill. 2000.
- ^ 5.0 5.1 Bear, Mark F.; Barry W. Connors and Michael A. Paradiso. Neuroscience: Exploring the Braine 2nd edition. Lippincott Williams & Wilkins Inc. 2001: 480–481.
- ^ 6.0 6.1 Wilson, C. J. Basal ganglia. Sheperd, G. M. (編). The Synaptic Organization of the Brain 4th edition. New York: Oxford Univ. Press. 1998.
- ^ DeLong, M. R. Putamen: activity of single units during slow and rapid arm movements. Science. 1973, 179: 1240–1242.
- ^ Kimura, M., Raijkowski, J., & Evarts, E. Tonically discharging putamen neurons exhibit set-dependent responses.. Proc. Natl. Acad. Sci. USA. 1984, 81: 4998–5001.
- ^ Graybiel, A. M., Aosaki, T., Flaherty, A. W., & Kimura, M. The basal ganglia and adaptive motor control. Science. 1994, 265: 1826–1831.
- ^ Hikosaka, O, & Wurtz, R. H. Effects of eye movements of a GABA agonist and antagonist injected into monkey superior colliculus. Brain Res. 1983, 272: 368–372.
- ^ Hikosaka, O; Takikawa, Y; Kawagoe, R. Role of the basal ganglia in the control of purposive saccadic eye movements. Physiological Reviews. 2000, 80 (3): 953–78. PMID 10893428. S2CID 7502211. doi:10.1152/physrev.2000.80.3.953.
- ^ 引用錯誤:沒有為名為
DABG的參考文獻提供內容 - ^ Eisinger, Robert S.; Urdaneta, Morgan E.; Foote, Kelly D.; Okun, Michael S.; Gunduz, Aysegul. Non-motor Characterization of the Basal Ganglia: Evidence From Human and Non-human Primate Electrophysiology. Frontiers in Neuroscience. 2018, 12: 385. ISSN 1662-453X. PMC 6041403 . PMID 30026679. doi:10.3389/fnins.2018.00385 (英語).
- ^ Eisinger, RS; Urdaneta, ME; Foote, KD; Okun, MS; Gunduz, A. Non-motor Characterization of the Basal Ganglia: Evidence From Human and Non-human Primate Electrophysiology. Frontiers in Neuroscience. 2018, 12: 385. PMC 6041403 . PMID 30026679. doi:10.3389/fnins.2018.00385 .
- ^ Redgrave, P.; Prescott, T.J.; Gurney, K. The Basal Ganglia: A Vertebrate Solution to the Selection Problem? (PDF). Neuroscience. April 1999, 89 (4): 1009–1023 [23 September 2019]. PMID 10362291. S2CID 3187928. doi:10.1016/S0306-4522(98)00319-4. (原始內容存檔 (PDF)於25 July 2018).
- ^ Maia, Tiago V.; Frank, Michael J. From Reinforcement Learning Models of the Basal Ganglia to the Pathophysiology of Psychiatric and Neurological Disorders. Nature Neuroscience. 15 January 2017, 14 (2): 154–162. ISSN 1097-6256. PMC 4408000 . PMID 21270784. doi:10.1038/nn.2723.
- ^ Hélie, Sébastien; Ell, Shawn W.; Ashby, F. Gregory. Learning robust cortico-cortical associations with the basal ganglia: an integrative review. Cortex. 1 March 2015, 64: 123–135. ISSN 1973-8102. PMID 25461713. S2CID 17994331. doi:10.1016/j.cortex.2014.10.011.
- ^ 引用錯誤:沒有為名為
BG models的參考文獻提供內容 - ^ Scahill, L., Erenberg, G., Berlin, C. M. Jr., Budman, C., Coffey, B. J., Jankovic, J., Kiessling, L., King, R. A., Kurlan, R., Lang, A., Mink, J., Murphy, T., Zinner, S., & Walkup, J. Tourette Syndrome Association Medical Advisory Board: Practice Committee. Contemporary assessment and pharmacotherapy of Tourette syndrome.. NeuroRx. 2006, 3(2): 192–206. PMID 16554257
- ^ Dystonia fact sheet: National Institute of Neurological Disorders and Stroke 存档副本. [2007-01-03]. (原始內容存檔於2006-12-05).
- ^ Blood, A. J., Tuch, D. S., Markis, N., Makhlouf, M., Sudarsky, L. R., Sharma, N. White matter abnormalities in dystonia normalize after botulinum toxin treatment. Neuroreport. 2006, 17: 1251–1255.
- ^ Alm PA. Stuttering and the basal ganglia circuits: a critical review of possible relations (PDF). Journal of communication disorders. 2004, 37 (4): 325–69. PMID 15159193.[失效連結]