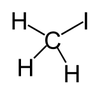
碘甲烷
碘甲烷是一个卤代烃,分子式写为CH3I、MeI,是甲烷的一碘取代物。室温下为密度大的挥发性液体,偶极矩1.59D,折射率1.5304(20°C、D)、1.5293(21°C、D)。碘甲烷可与常见的有机溶剂混溶,纯品无色,暴露于阳光下会分解出I2而带紫色,可通过加入金属铜或银去除。自然界中碘甲烷少量存在于稻田中。[1]温带海洋中的藻类以及陆地上的某些真菌和细菌也可以代谢产生碘甲烷。
| 碘甲烷 | |||
|---|---|---|---|
| |||
| IUPAC名 Iodomethane | |||
| 别名 | 一碘甲烷、甲基碘、碘代甲烷 | ||
| 识别 | |||
| 缩写 |
| ||
| CAS号 | 74-88-4 | ||
| PubChem | 6328 | ||
| ChemSpider | 6088 | ||
| SMILES |
| ||
| InChI |
| ||
| Beilstein | 969135 | ||
| Gmelin | 1233 | ||
| UN编号 | 2644 | ||
| EINECS | 200-819-5 | ||
| ChEBI | 39282 | ||
| RTECS | PA9450000 | ||
| KEGG | C18448 | ||
| MeSH | methyl+iodide | ||
| 性质 | |||
| 化学式 | CH3I | ||
| 摩尔质量 | 141.94 g·mol⁻¹ | ||
| 外观 | 无色澄清有刺鼻气味的液体 | ||
| 密度 | 2.2789 g/cm3, 20 °C | ||
| 熔点 | -66.45 °C (206.70 K) | ||
| 沸点 | 42.43 °C (315.58 K) | ||
| 溶解性(水) | 14 g/l, 20 °C | ||
| log P | 1.51 | ||
| 蒸气压 | 50 kPa, 20 °C 53.32, 25.3 °C 166.1 kPa, 55 °C | ||
| 结构 | |||
| 分子构型 | 四面体 | ||
| 危险性 | |||
| 欧盟分类 | 有毒 (T) Carc. Cat. 3 | ||
| H-术语 | H301, H312, H315, H331, H335, H351 | ||
| P-术语 | P261, P280, P301+310, P311 | ||
| NFPA 704 | |||
| 闪点 | -28 °C | ||
| 自燃温度 | 352 °C | ||
| 爆炸极限 | 8.5 - 66% | ||
| 相关物质 | |||
| 其他阴离子 | 氟甲烷、一氯甲烷 溴甲烷 | ||
| 相关甲基化试剂 | 碳酸二甲酯 硫酸二甲酯 三氟甲磺酸甲酯 | ||
| 相关化学品 | 二碘甲烷、碘仿 四碘化碳 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
化学性质
编辑碘甲烷是SN2取代反应的理想底物,一方面由于其位阻效应很小,便于亲核试剂进攻;另一方面由于碘离子是很好的离去基团。因此,碘甲烷可用于对酚和羧酸进行甲基化:[2]
这些例子中,碱(K2CO3或Li2CO3)移除羧酸或酚的酸性质子,使之形成羧酸根离子和酚盐离子,然后作为亲核试剂发生SN2反应。
根据软硬酸碱理论,碘是“软”的阴离子,因而碘甲烷所参与的甲基化反应也应在两位亲核试剂较“软”的一段发生。比如,在与硫氰酸根离子反应时,S更软,因而从S原子进攻的可能性较从N原子进攻的可能性大,产物主要是硫氰酸甲酯(CH3SCN)而非CH3NCS。而且,碘甲烷与1,3-二羰基化合物生成的烯醇盐之间发生的反应也可用以上理论来解释。相对于碳原子,氧原子较硬,碘甲烷参与的反应也几乎都生成C-甲基化的产物。
虽然一般不用碘代烃来生成格氏试剂,但由于氟甲烷、一氯甲烷和溴甲烷在室温下都为气体,所以碘甲烷也是制取一碳格氏试剂的主要原料,生成的格氏试剂称为碘化甲基镁MeMgI。该生成反应速率很快,常用于演示格氏试剂的制备。碘化甲基镁的应用在某些方面现在已被甲基锂所取代。
在蒙山都法中,甲醇与碘化氢反应生成的中间体MeI,很快便在铑催化剂存在下与一氧化碳反应生成乙酰碘,然后水解生成目标产物乙酸。
制备
编辑在甲醇与红磷的混合物中加入碘时,会发生放热反应而生成碘甲烷:[3]
反应中生成了三碘化磷中间体,起到了与甲醇发生碘化反应的作用。
此外,碘甲烷也可由硫酸二甲酯与碘化钾在碳酸钙存在下反应制得:[3]
- (CH3O)2SO2 + KI → K2SO4 + 2 CH3I
保存与纯化
编辑和其他许多有机碘化物一样,碘甲烷试剂通常存放在棕色瓶中以防止其见光分解生成单质碘而使得试剂略带紫色。商品化的碘甲烷试剂中通常会加入铜或银丝使其稳定。也可以通过先用硫代硫酸钠洗涤后蒸馏的方法来除去碘单质。
甲基化反应
编辑碘甲烷是很好的甲基化试剂,但仍有一些缺点:
- 它相对分子质量较大,一摩尔MeI的质量几乎等于三摩尔CH3Cl的质量;
- 碘化合物较氯化物和溴化物仍显得比较昂贵,因而在工业上更加便宜的硫酸二甲酯仍有不少应用,尽管它的毒性比碘甲烷要高出很多;
- 碘离子离去基团可能会造成副反应;
- 碘甲烷的毒性比相应的氯化合物和溴化合物要大,对生产工人很不利。
因此在选择甲基化试剂时,通常要均衡考虑价格、来源、毒性、化学选择性及反应容易程度等诸多因素。
用途
编辑除了用作甲基化试剂外,碘甲烷的应用还有:
毒性
编辑小白鼠口服碘甲烷的LD50为76mg/kg。在IARC、ACGIH、NTP或EPA分类中,碘甲烷属于可能致癌物质;IARC(国际癌症研究机构)将其划为第三类,即“尚不清楚其对人体致癌作用”。
肝脏中,碘甲烷被代谢为S-甲基谷胱甘肽。[4] 吸入碘甲烷的烟雾可能造成对肺、肝、肾和中枢神经系统的损伤,可能导致恶心、眩晕、咳嗽或呕吐,长期皮肤接触会造成灼伤,吸入大量会造成肺水肿。
参见
编辑参考资料
编辑- ^ K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone. Emissions of Methyl Halides and Methane from Rice Paddies. Science. 2000, 290: 966–969. doi:10.1126/science.290.5493.966.
- ^ Avila-Zárraga, J. G., Martínez, R. Efficient methylation of carboxylic acids with potassium hydroxide/methyl sulfoxide and iodomethane. Synthetic Communications. January 2001, 31 (14): 2177–2183. doi:10.1081/SCC-100104469.
- ^ 3.0 3.1 King, C. S.; Hartman, W. W. (1943). "Methyl Iodide". Org. Synth.; Coll. Vol. 2: 399.
- ^ Johnson, M. K. Metabolism of iodomethane in the rat. Biochem. J. 1966, 98: 38–43.
- March, J. (1992). Advanced Organic Chemistry, 4th Edn., New York: Wiley. ISBN 0-471-60180-2.
- Sulikowski, G. A.; Sulikowski, M. M. (1999). in Coates, R.M.; Denmark, S. E. (Eds.) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation New York: Wiley, pp. 423–26.
- Bolt H. M., Gansewendt B. Mechanisms of carcinogenicity of methyl halides.. Crit Rev Toxicol. 1993, 23 (3): 237–53.
外部链接
编辑- 国际化学品安全卡0509
- 国际癌症研究机构—Vol. 15 (1977) (页面存档备份,存于互联网档案馆), Vol. 41 (1986) (页面存档备份,存于互联网档案馆), Vol. 71 (1999) (页面存档备份,存于互联网档案馆)
- MSDS—牛津大学 (页面存档备份,存于互联网档案馆)
- 三氘代碘甲烷的MSDS—牛津大学 (页面存档备份,存于互联网档案馆)
- 碘甲烷在老鼠中的代谢 (页面存档备份,存于互联网档案馆)
- 碘甲烷的NMR谱