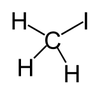
碘甲烷
碘甲烷是一個鹵代烴,分子式寫為CH3I、MeI,是甲烷的一碘取代物。室溫下為密度大的揮發性液體,偶極矩1.59D,折射率1.5304(20°C、D)、1.5293(21°C、D)。碘甲烷可與常見的有機溶劑混溶,純品無色,暴露於陽光下會分解出I2而帶紫色,可通過加入金屬銅或銀去除。自然界中碘甲烷少量存在於稻田中。[1]溫帶海洋中的藻類以及陸地上的某些真菌和細菌也可以代謝產生碘甲烷。
| 碘甲烷 | |||
|---|---|---|---|
| |||
| IUPAC名 Iodomethane | |||
| 別名 | 一碘甲烷、甲基碘、碘代甲烷 | ||
| 識別 | |||
| 縮寫 |
| ||
| CAS號 | 74-88-4 | ||
| PubChem | 6328 | ||
| ChemSpider | 6088 | ||
| SMILES |
| ||
| InChI |
| ||
| Beilstein | 969135 | ||
| Gmelin | 1233 | ||
| UN編號 | 2644 | ||
| EINECS | 200-819-5 | ||
| ChEBI | 39282 | ||
| RTECS | PA9450000 | ||
| KEGG | C18448 | ||
| MeSH | methyl+iodide | ||
| 性質 | |||
| 化學式 | CH3I | ||
| 莫耳質量 | 141.94 g·mol⁻¹ | ||
| 外觀 | 無色澄清有刺鼻氣味的液體 | ||
| 密度 | 2.2789 g/cm3, 20 °C | ||
| 熔點 | -66.45 °C (206.70 K) | ||
| 沸點 | 42.43 °C (315.58 K) | ||
| 溶解性(水) | 14 g/l, 20 °C | ||
| log P | 1.51 | ||
| 蒸氣壓 | 50 kPa, 20 °C 53.32, 25.3 °C 166.1 kPa, 55 °C | ||
| 結構 | |||
| 分子構型 | 四面體 | ||
| 危險性 | |||
| 歐盟分類 | 有毒 (T) Carc. Cat. 3 | ||
| H-術語 | H301, H312, H315, H331, H335, H351 | ||
| P-術語 | P261, P280, P301+310, P311 | ||
| NFPA 704 | |||
| 閃點 | -28 °C | ||
| 自燃溫度 | 352 °C | ||
| 爆炸極限 | 8.5 - 66% | ||
| 相關物質 | |||
| 其他陰離子 | 氟甲烷、一氯甲烷 溴甲烷 | ||
| 相關甲基化試劑 | 碳酸二甲酯 硫酸二甲酯 三氟甲磺酸甲酯 | ||
| 相關化學品 | 二碘甲烷、碘仿 四碘化碳 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
化學性質
編輯碘甲烷是SN2取代反應的理想底物,一方面由於其位阻效應很小,便於親核試劑進攻;另一方面由於碘離子是很好的離去基團。因此,碘甲烷可用於對酚和羧酸進行甲基化:[2]
這些例子中,鹼(K2CO3或Li2CO3)移除羧酸或酚的酸性質子,使之形成羧酸根離子和酚鹽離子,然後作為親核試劑發生SN2反應。
根據軟硬酸鹼理論,碘是「軟」的陰離子,因而碘甲烷所參與的甲基化反應也應在兩位親核試劑較「軟」的一段發生。比如,在與硫氰酸根離子反應時,S更軟,因而從S原子進攻的可能性較從N原子進攻的可能性大,產物主要是硫氰酸甲酯(CH3SCN)而非CH3NCS。而且,碘甲烷與1,3-二羰基化合物生成的烯醇鹽之間發生的反應也可用以上理論來解釋。相對於碳原子,氧原子較硬,碘甲烷參與的反應也幾乎都生成C-甲基化的產物。
雖然一般不用碘代烴來生成格氏試劑,但由於氟甲烷、一氯甲烷和溴甲烷在室溫下都為氣體,所以碘甲烷也是製取一碳格氏試劑的主要原料,生成的格氏試劑稱為碘化甲基鎂MeMgI。該生成反應速率很快,常用於演示格氏試劑的製備。碘化甲基鎂的應用在某些方面現在已被甲基鋰所取代。
在蒙山都法中,甲醇與碘化氫反應生成的中間體MeI,很快便在銠催化劑存在下與一氧化碳反應生成乙醯碘,然後水解生成目標產物乙酸。
製備
編輯在甲醇與紅磷的混合物中加入碘時,會發生放熱反應而生成碘甲烷:[3]
反應中生成了三碘化磷中間體,起到了與甲醇發生碘化反應的作用。
此外,碘甲烷也可由硫酸二甲酯與碘化鉀在碳酸鈣存在下反應製得:[3]
- (CH3O)2SO2 + KI → K2SO4 + 2 CH3I
保存與純化
編輯和其他許多有機碘化物一樣,碘甲烷試劑通常存放在棕色瓶中以防止其見光分解生成單質碘而使得試劑略帶紫色。商品化的碘甲烷試劑中通常會加入銅或銀絲使其穩定。也可以通過先用硫代硫酸鈉洗滌後蒸餾的方法來除去碘單質。
甲基化反應
編輯碘甲烷是很好的甲基化試劑,但仍有一些缺點:
- 它相對分子質量較大,一摩爾MeI的質量幾乎等於三摩爾CH3Cl的質量;
- 碘化合物較氯化物和溴化物仍顯得比較昂貴,因而在工業上更加便宜的硫酸二甲酯仍有不少應用,儘管它的毒性比碘甲烷要高出很多;
- 碘離子離去基團可能會造成副反應;
- 碘甲烷的毒性比相應的氯化合物和溴化合物要大,對生產工人很不利。
因此在選擇甲基化試劑時,通常要均衡考慮價格、來源、毒性、化學選擇性及反應容易程度等諸多因素。
用途
編輯除了用作甲基化試劑外,碘甲烷的應用還有:
毒性
編輯小白鼠口服碘甲烷的LD50為76mg/kg。在IARC、ACGIH、NTP或EPA分類中,碘甲烷屬於可能致癌物質;IARC(國際癌症研究機構)將其劃為第三類,即「尚不清楚其對人體致癌作用」。
肝臟中,碘甲烷被代謝為S-甲基穀胱甘肽。[4] 吸入碘甲烷的煙霧可能造成對肺、肝、腎和中樞神經系統的損傷,可能導致噁心、眩暈、咳嗽或嘔吐,長期皮膚接觸會造成灼傷,吸入大量會造成肺水腫。
參見
編輯參考資料
編輯- ^ K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone. Emissions of Methyl Halides and Methane from Rice Paddies. Science. 2000, 290: 966–969. doi:10.1126/science.290.5493.966.
- ^ Avila-Zárraga, J. G., Martínez, R. Efficient methylation of carboxylic acids with potassium hydroxide/methyl sulfoxide and iodomethane. Synthetic Communications. January 2001, 31 (14): 2177–2183. doi:10.1081/SCC-100104469.
- ^ 3.0 3.1 King, C. S.; Hartman, W. W. (1943). "Methyl Iodide". Org. Synth.; Coll. Vol. 2: 399.
- ^ Johnson, M. K. Metabolism of iodomethane in the rat. Biochem. J. 1966, 98: 38–43.
- March, J. (1992). Advanced Organic Chemistry, 4th Edn., New York: Wiley. ISBN 0-471-60180-2.
- Sulikowski, G. A.; Sulikowski, M. M. (1999). in Coates, R.M.; Denmark, S. E. (Eds.) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation New York: Wiley, pp. 423–26.
- Bolt H. M., Gansewendt B. Mechanisms of carcinogenicity of methyl halides.. Crit Rev Toxicol. 1993, 23 (3): 237–53.
外部連結
編輯- 國際化學品安全卡0509
- 國際癌症研究機構—Vol. 15 (1977) (頁面存檔備份,存於網際網路檔案館), Vol. 41 (1986) (頁面存檔備份,存於網際網路檔案館), Vol. 71 (1999) (頁面存檔備份,存於網際網路檔案館)
- MSDS—牛津大學 (頁面存檔備份,存於網際網路檔案館)
- 三氘代碘甲烷的MSDS—牛津大學 (頁面存檔備份,存於網際網路檔案館)
- 碘甲烷在老鼠中的代謝 (頁面存檔備份,存於網際網路檔案館)
- 碘甲烷的NMR譜