氫化鋁
氫化鋁(AlH3)是鋁的氫化物。用作還原劑。用於炔烴的鋁氫化反應、烯丙重排反應以及氫燃料汽車中氫氣的儲存。[1][2]
| 氫化鋁 | |
|---|---|
| |
| IUPAC名 aluminium trihydride alumane trihydridoaluminium | |
| 別名 | Aluminium(III) hydride Alane |
| 識別 | |
| CAS號 | 7784-21-6 ? |
| PubChem | 14488 |
| ChemSpider | 13833 |
| SMILES |
|
| InChI |
|
| InChIKey | AZDRQVAHHNSJOQ-FSBNLZEDAV |
| 性質 | |
| 化學式 | AlH3 |
| 莫耳質量 | 29.99 g·mol⁻¹ |
| 外觀 | 無色至白色晶體,易揮發,高聚合度,針狀 |
| 密度 | 1.486 g/cm3,固體 |
| 熔點 | 150 °C |
| 沸點 | 分解 |
| 溶解性(水) | 反應 |
| 結構 | |
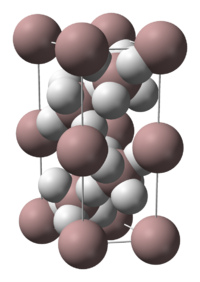
| 晶體結構 | 六方晶系 |
| 相關物質 | |
| 相關化學品 | 氫化鋁鋰 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氫化鋁是無色的聚合結構固體((AlH3)n)。
歷史
編輯氫化鋁最早是以雜質或胺/醚絡合物的形式得到。[3]直到1947年,芝加哥大學的 Finholt 等才首次製得純的氫化鋁。[4]
結構與物理性質
編輯氫化鋁有多種晶型,較為常見的有 α-、α'-、β-、δ-、ε-、θ- 和 γ-型。α-氫化鋁為立方或菱方結構,每個 Al 原子被6個 H 原子包圍,每個 H 原子再各自與另外一個 Al 原子橋連;Al-H 鍵長均為 172 pm,Al-H-Al 角為 141°。[5]α'-型氫化鋁則為針狀結晶。
氫化鋁可溶於四氫呋喃和醚。
氫化鋁分子
編輯AlH3單體已在低溫的固體惰性氣體基質中分離,結構為平面型分子,很不穩定。[6]它的二聚體Al2H6已在固態氫中分離。它的結構和乙硼烷(B2H6)以及乙鎵烷(Ga2H6)一樣。[7][8]
化學性質
編輯α-氫化鋁為熱穩定性最高的晶型。
β- 和 γ-型氫化鋁通常會共同生成,並且在加熱時會轉變為 α-氫化鋁。δ-、ε- 和 θ-氫化鋁則在不同的結晶條件下生成;雖然其穩定性不及 α-變體,但加熱時並不會發生晶型轉變。[9]
AlH3 可與強路易斯鹼很快形成加合物。例如它可與三甲胺形成 1:1 和 1:2 兩種加合物。1:1加合物在氣相是四面體型結構,[10]在固態則為含有氫橋的二聚結構——(NMe3Al(μ-H))2。[11]1:2加合物為三角雙錐結構。[10]
某些加合物如乙基二甲基胺-氫化鋁(NMe2Et.AlH3)可遇熱分解為金屬鋁,可能在有機金屬化學氣相沉積有潛在的應用。[12]
製取
編輯氫化鋁一般是通過用氫化鋁鋰的醚溶液與三氯化鋁作用而製得。反應後得到的是氫化鋁的醚溶液。另一個產物氯化鋰則沉澱出來。反應時一般需要加入 0.5-4 mol 的硼氫化物以助於三氯化鋁的溶解。硼氫化物的價格較貴,並且反應後不能回收,從而增加了氫化鋁的製取成本。[1]
- 3 LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
氫化鋁的醚溶液需要現制現用,否則 AlH3 與醚形成的聚合物會與 AlH3 一同沉澱出來。AlH3 溶液通常會在製備3日後變質。
AlH3 活性高於氫化鋁鋰。它在使用時的注意事項與氫化鋁鋰相似。[9]相關實驗需在通風櫥中進行。[9]
此外還可通過如下方法製取氫化鋁:
- 2 LiAlH4 + BeCl2 → 2 AlH3 + LiBeH2Cl2
- 2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2[來源請求]
- 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
用途
編輯還原劑
編輯氫化鋁在有機合成中最常用的用途是作為還原劑,它在很多方面與氫化鋁鋰都很相似。它可將醛、酮、羧酸、酸酐、醯氯、酯和內酯分別還原為相應的醇。與醯胺、腈和肟作用時,則可將其還原為相應的胺。
氫化鋁在反應選擇性方面與其他氫化物還原劑有所不同。例如,在如下環己酮衍生物的還原反應中,用氫化鋁鋰作還原劑,得到的順:反異構體之比為1.9:1;用氫化鋁作還原劑,產生的順:反異構體比例則為7.3:1。[13]
Corey 等發展了一種對某些酮類進行羥甲基化的方法。[14](酮以烯醇負離子的形式「被保護」,因此未被還原)
氫化鋁對鹵代烴的還原很慢,有時甚至無法進行。下面的反應就是利用了這個性質,只讓羧基被還原,而鹵原子保持不變。[15]
用氫化鋁促進的烯丙重排反應為 SN2 反應,對於立體位阻的底物也適用。[19]
鋁氫化反應
編輯氫化鋁可對炔丙醇進行加成。[20]與四氯化鈦共用時,氫化鋁可對碳碳雙鍵進行加成。[21]反應類似於硼氫化反應。
其他
編輯氫化鋁可能是氫燃料汽車中用於儲氫的適宜材料。氫化鋁含有10%的氫(質量),並可儲存148g/L的氫(液氫密度的兩倍)。不過迄今為止還沒有很成功的將鋁副產物重新轉化為 AlH3 的方法。
氫化鋁是火箭推進劑之一。也用於爆破與煙火用途。 可做為疫苗額外添加的佐劑。
化學反應
編輯氫化鋁(的醚絡合物)遇空氣或水均會劇烈分解,產物是複雜的、與乙醚形成的鋁二乙醚合物。
- AlH3 + (C2H5)2O → H3Al·O(C2H5)2
- 4 AlH3 + 3 CO2 → 3 CH4 + 2 Al2O3
- AlH3 + LiH → LiAlH4
危害
編輯氫化鋁並不會自發燃燒。它的處理類似氫化鋁鋰。氫化鋁會在空氣或水中分解,將其鈍化會大幅減少分解率。氫化鋁遇水會放出可燃氣體。[22]
用氫化鋁還原三氟甲基化合物可能會爆炸。[23]
參考資料
編輯- ^ 1.0 1.1 Galatsis, P. In Encyclopedia of Reagents for Organic Synthesis; University of Guelph, Ontario, Canada
- ^ Brown, H. C.; Krishnamurthy, S. Tetrahedron 1979, 35, 567. (Review)
- ^ F. M. Brower, N. E. Matzek, P. F. Reigler, H. W. Rinn, C. B. Roberts, D. L. Schmidt, J. A. Snover, K. Terada. Preparation and properties of aluminum hydride. Journal of the American Chemical Society (J. Am. Chem. Soc.). 1976, 98: 2450–2454. doi:10.1021/ja00425a011.
- ^ A. E. Finholt, A. C. Bond, Jr., H. I. Schlesinger. Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry. J. Am. Chem. Soc. 1947, 69: 1199–1203. doi:10.1021/ja01197a061.
- ^ Turley J W,. Rinn H W. The crystal structure of aluminum hydride. Inorganic Chemistry. 1969, 8 (1): 18–22. doi:10.1021/ic50071a005.
- ^ Kurth, F. A.; Eberlein, R. A.; Schnöckel, H.-G.; Downs, A. J.; Pulham, C. R. Molecular Aluminium Trihydride, AlH3: Generation in a Solid Noble Gas Matrix and Characterisation by its Infrared Spectrum and ab initio Calculations. Journal of the Chemical Society, Chemical Communications. 1993, 1993 (16): 1302–1304. doi:10.1039/C39930001302.
- ^ Andrews, L.; Wang, X. The Infrared Spectrum of Al2H6 in Solid Hydrogen. Science. 2003, 299 (5615): 2049–2052. Bibcode:2003Sci...299.2049A. PMID 12663923. S2CID 45856199. doi:10.1126/science.1082456.
- ^ Pulham, C. R.; Downs, A. J.; Goode, M. J.; Rankin D. W. H.; Robertson, H. E. Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 as Determined by Electron Diffraction. Journal of the American Chemical Society. 1991, 113 (14): 5149–5162. doi:10.1021/ja00014a003.
- ^ 9.0 9.1 9.2 Lund, Gary K., Hanks, Jami M., Johnston, Harold E., US Patent and Trade Office, 2007, Pat. Application # 20070066839
- ^ 10.0 10.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Atwood JL , Bennett FR, Elms FM, Jones C, Raston CL, Robinson KD. Tertiary amine stabilized dialane. J. Am. Chem. Soc. 1991, 113 (21): 8183–8185. doi:10.1021/ja00021a063.
- ^ Jong-Ho Yun, Byoung-Youp Kim and Shi-Woo Rhee. Metal-organic chemical vapor deposition of aluminum from dimethylethylamine alane. Thin Solid Films. 1998, 312 (1-2): 259–263. doi:10.1016/S0040-6090(97)00333-7.
- ^ Ayres, D. C.; Sawdaye, R. J. Chem. Soc., Perkin Trans, 1967, 581.
- ^ E. J. Corey, David E. Cane. Controlled hydroxymethylation of ketones. J. Org. Chem. 1971, 36 (20): 3070–3070. doi:10.1021/jo00819a047.
- ^ Danishefsky, S.; Regan, J. Tetrahedron, 1962, 559.
- ^ S. Takano, M. Akiyama, S. Sato, K. Orgasawara, Chem. Lett., 1983, 1593.
- ^ W. J. Richter. Asymmetric synthesis at prochiral centers: substituted 1, 3-dioxolanes. J. Org. Chem. 1981, 46: 5119–5124. doi:10.1021/jo00338a011.
- ^ K. Maruoka, S. Saito, T. Ooi, H. Yamamoto, H. Synlett, 1991, 255.
- ^ A. Claesson, L.-I. Olsson. Allenes and acetylenes. 22. Mechanistic aspects of the allene-forming reductions (SN2' reaction) of chiral propargylic derivatives with hydride reagents. J. Am. Chem. Soc. 1979, 101: 7302–7311. doi:10.1021/ja00518a028.
- ^ Corey, E. J.; Katzenellenbogen, J. A.; Gary H. Posner J. Am. Chem. Soc. 1967, 89, 4245.
- ^ Sato, F.; Sato, S.; Kodama, H.; Sato, M. J. Organomet. Chem. 1977, 142, 71.
- ^ 2013 CFR Title 29 Volume 6 Section 1900.1200 Appendix B.12
- ^ Taydakov, Ilya V. Serious Explosion during Large-Scale Preparation of an Amine by Alane (AlH3) Reduction of a Nitrile Bearing a CF3 Group. ACS Chemical Health & Safety (American Chemical Society (ACS)). 2020-07-08, 27 (4): 235–239. ISSN 1871-5532. doi:10.1021/acs.chas.0c00045.