次氯酸盐
次氯酸盐是次氯酸的盐,含有次氯酸根离子ClO−,其中氯的氧化态为+1。次氯酸盐常以溶液态存在,不稳定,会发生歧化反应生成氯酸盐和氯化物。见光分解为氯化物和氧气。常见的次氯酸盐包括次氯酸钠(漂白剂)和次氯酸钙(漂白粉),都是很强的氧化剂,可与很多有机化合物强烈放热反应,可能发生燃烧。可氧化锰化合物为高锰酸盐。次氯酸根中的 Cl-O 键长是 210 pm。[1]
| 次氯酸盐 | |
|---|---|
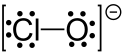
| |

| |
| IUPAC名 Hypochlorite | |
| 系统名 chlorate(I) | |
| 识别 | |
| CAS号 | 14380-61-1 |
| PubChem | 61739 |
| ChemSpider | 55632 |
| SMILES |
|
| InChI |
|
| InChIKey | WQYVRQLZKVEZGA-UHFFFAOYAZ |
| Gmelin | 682 |
| UN编号 | 3212 |
| ChEBI | 29222 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
反应
编辑和酸的反应
编辑次氯酸盐和酸反应形成次氯酸,并和氯气形成平衡。在高pH下平衡会趋向左边:
- 2 H+
+ ClO−
+ Cl−
⇌ Cl
2 + H
2O
稳定性
编辑次氯酸盐普遍不稳定,只能存在于溶液。次氯酸锂(LiClO)、次氯酸钙(Ca(ClO)2)和次氯酸钡(Ba(ClO)2)已经得到了纯的无水物。它们都是固体。剩下的都只能以水合物或水溶液的形式存在。一般来说,水溶液越稀就越稳定。对于碱土金属次氯酸盐的性质推测是不可能的,因为大部分次氯酸盐都仍未合成。次氯酸铍不存在。纯的次氯酸镁不存在,不过Mg(OH)ClO是已知的。[3] 次氯酸钙的生产已是工业级的了,稳定性也较好。次氯酸锶(Sr(ClO)2)的性质及稳定性都不明确。[來源請求]
- 2 ClO−
→ 2 Cl−
+ O
2 - 3 ClO−
→ 2 Cl−
+ ClO−
3
这个反应是放热的,因此纯的LiClO和Ca(ClO)2会导致热失控,可能会爆炸。[4]
碱金属次氯酸盐随着族往下,越来越不稳定。无水次氯酸锂在室温下稳定。不过,次氯酸钠已经不能合成到比五水物 (NaClO·(H2O)5)更干的次氯酸钠了。它在 0 °C以上是不稳定的,[5] 尽管作为家用漂白剂的稀次氯酸钠溶液具有更好的稳定性。次氯酸钾 (KClO) 只在溶液中存在。[3]
镧系元素次氯酸盐不稳定。不过,有报告称它们的无水物比水合物更稳定。[6] 次氯酸盐可以把铈的氧化态从 +3 氧化到+4。[7]
和氨的反应
编辑次氯酸盐和氨反应,形成氯胺 (NH
2Cl),之后是二氯胺 (NHCl
2),最后是三氯化氮 (NCl
3)。[8]
- NH
3 + ClO−
→ HO−
+ NH
2Cl
- NH
2Cl + ClO−
→ HO−
+ NHCl
2
- NHCl
2 + ClO−
→ HO−
+ NCl
3
檢驗
编辑溶解性
编辑参见
编辑参考资料
编辑- ^ Aleksandrova, M.M.; Dmitriev, G.A.; Avojan, R.L. The probable model of the crystal structure of the twobase calcium hypochlorite. Armyanskii Khimicheskii Zhurnal. 1968, 21: 380 - 386.
- ^ Mintz, M. J.; C. Walling. t-Butyl hypochlorite. Organic Syntheses. 1969, 49: 9 [2021-05-13]. doi:10.15227/orgsyn.049.0009. (原始内容存档于2013-09-13).
- ^ 3.0 3.1 Aylett, founded by A.F. Holleman ; continued by Egon Wiberg ; translated by Mary Eagleson, William Brewer ; revised by Bernhard J. Inorganic chemistry 1st English ed., [edited] by Nils Wiberg. San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. 2001: 444. ISBN 978-0123526519.
- ^ Clancey, V.J. Fire hazards of calcium hypochlorite. Journal of Hazardous Materials. 1975, 1 (1): 83–94. doi:10.1016/0304-3894(75)85015-1.
- ^ Brauer, G. Handbook of Preparative Inorganic Chemistry; Vol. 1 2nd. Academic Press. 1963: 309.
- ^ Vickery, R. C. Some reactions of cerium and other rare earths with chlorine and hypochlorite. Journal of the Society of Chemical Industry. 1 April 1950, 69 (4): 122–125. doi:10.1002/jctb.5000690411.
- ^ V. R. Sastri; et al. Modern Aspects of Rare Earths and their Complexes. 1st. Burlington: Elsevier. 2003: 38. ISBN 978-0080536682.
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ Prescott, A.B.; Johnson, O.C. Qualitative Chemical Analysis: A Guide in Qualitative Work, with Data for Analytical Operations and Laboratory Methods in Inorganic Chemistry. D. Van Nostrand Company. 1901: 337 [2021-11-27]. (原始内容存档于2021-11-27).