溴化钴
化合物
| 溴化钴 | |
|---|---|
| |

| |
| 识别 | |
| CAS号 | 7789-43-7 |
| PubChem | 24610 |
| ChemSpider | 23012 |
| SMILES |
|
| InChI |
|
| InChIKey | BZRRQSJJPUGBAA-NUQVWONBAJ |
| RTECS | GF9595000 |
| 性质 | |
| 化学式 | CoBr2 |
| 摩尔质量 | 218.7412 g/mol(无水) 326.74 g/mol(六水) g·mol⁻¹ |
| 外观 | 亮绿色晶体(无水) 紫红色晶体(六水) |
| 密度 | 4.909 g/cm3 (无水) 2.46 g/cm3 (六水) |
| 熔点 | 678 °C(951 K) |
| 溶解性(水) | 无水: 66.7 g/100 mL (59 °C) 68.1 g/100 mL (97 °C) 六水: 113.2 g/100 mL (20 °C) |
| 溶解性 | 77.1 g/100 mL (乙醇, 20 °C) 58.6 g/100 mL (甲醇, 30 °C) 可溶于乙酸甲酯、乙醚和丙酮 |
| 磁化率 | +13000·10−6 cm3/mol |
| 结构 | |
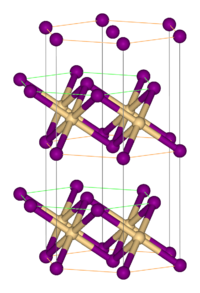
| 晶体结构 | 三方晶系, hP3 空间群:P-3m1, No. 164 |
| 配位几何 | 八面体 |
| 危险性 | |
| 警示术语 | R:R36, R37, R38 |
| 安全术语 | S:S26, S37, S39, S45, S28A |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 致死量或浓度: | |
LD50(中位剂量)
|
406 mg/kg(大鼠,口) |
| 相关物质 | |
| 其他阴离子 | 氟化钴 氯化钴 碘化钴 |
| 其他阳离子 | 溴化亚铁 溴化镍 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
性质
编辑无水溴化钴是绿色晶体,六水合物在100 °C失水,得到二水合物:
- CoBr2.6H2O → CoBr2·2H2O + 4 H2O
二水合物在130 °C完全失水,得到无水物
- CoBr2·2H2O → CoBr2 + 2 H2O
无水物的熔点为678 °C[1][2],在更高温度和氧反应,形成四氧化三钴并放出溴蒸气。
溴化钴和氨水反应,形成二价的钴氨配合物,该配合物经过氧化氢氧化,得到稳定的三价钴配合物二溴化一溴五氨合钴(III):[3]
- 2 CoBr2 + 8 NH3 + 2 NH4Br + H2O2 → 2 [Co(NH3)5Br]Br2 + 2 H2O
制备
编辑- Co(OH)2(s) + 2 HBr(aq) → CoBr2 + 2 H2O
参考文献
编辑- ^ Cobalt Bromide Supplier & Tech Info. American Elements. [2017-08-14]. (原始内容存档于2015-04-04).
- ^ WebElements Periodic Table of the Elements. [2017-08-14]. (原始内容存档于2008-05-12).
- ^ Diehl, Harvey; Clark, Helen; Willard, H. H.; Bailar, John C. Bromopentamminocobalti Bromide. Inorganic Syntheses. Inorganic Syntheses 1. 1939: 186. ISBN 978-0-470-13232-6. doi:10.1002/9780470132326.ch66.
- ^ WebElements Periodic Table of the Elements | Cobalt | Essential information. [2017-08-14]. (原始内容存档于2008-04-02).
- ^ Chemical Properties and Reaction Tendencies 互联网档案馆的存檔,存档日期2008-02-19.
- ^ Pilgaard Solutions: Cobalt 互联网档案馆的存檔,存档日期2009-01-22.
