四氯化鋯
化合物
四氯化鋯,是一種鋯化合物,並且是多種鋯鹽的前體。
| 四氯化鋯 | |
|---|---|
| |

| |
| IUPAC名 Zirconium tetrachloride Zirconium(IV) chloride | |
| 識別 | |
| CAS號 | 10026-11-6 |
| PubChem | 24817 |
| ChemSpider | 23202 |
| SMILES |
|
| InChI |
|
| InChIKey | DUNKXUFBGCUVQW-XBHQNQODAQ |
| EINECS | 233-058-2 |
| ChEBI | 77566 |
| 性質 | |
| 化學式 | ZrCl4 |
| 摩爾質量 | 233.04 g/mol g·mol⁻¹ |
| 外觀 | 白色易潮解晶體 |
| 密度 | 2.80 g/cm3 |
| 熔點 | 437 °C(710 K)((三相點)) |
| 沸點 | 331 °C(604 K)((升華)) |
| 溶解性(水) | 水解 |
| 溶解性 | 溶於乙醇,醚和濃鹽酸 |
| 結構 | |
| 晶體結構 | 單斜, mP10 |
| 空間群 | P12/c1, No. 13 |
| 熱力學 | |
| ΔfHm⦵298K | −980.52 kJ/mol |
| S⦵298K | 181.41 J K−1 mol−1 |
| 熱容 | 125.38 J K−1 mol−1 |
| 危險性 | |
| MSDS | MSDS |
| 歐盟編號 | 未列出 |
| 閃點 | 不可燃 |
| 致死量或濃度: | |
LD50(中位劑量)
|
1688 mg/kg(大鼠,口服) |
| 相關物質 | |
| 其他陰離子 | 四氟化鋯 四溴化鋯 四碘化鋯 |
| 其他陽離子 | 四氯化鈦 四氯化鉿 |
| 相關化學品 | 二氯化鋯 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
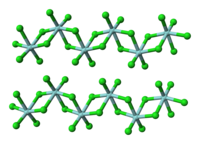
結構
編輯與四氯化鈦不同,固態的ZrCl4中存在着以鋯原子為中心的含有氯橋連接的八面體配位結構。這也就解釋了它們在熔點上的巨大差異。這種結構還出現在HfCl4中。當使用路易斯鹼進行處理時,Zr-Cl-Zr形式的氯橋會斷裂,從而使聚合物分解。[1]例如,四氯化鋯可以和含羥基的配體發生氯置換反應,和水反應可生成ZrOCl2。[2]
製備
編輯性質和用途
編輯四氯化鋯是一種弱的路易斯酸,能與五氯化磷形成加合物ZrCl4·PCl5和ZrCl4·2PCl5,或和鹼金屬或鹼土金屬氯化物形成六氯鋯酸鹽。[2]此外,它還可以代替三氯化鋁參與傅-克反應和狄爾斯–阿爾德反應。[3]
四氯化鋯是用於對二氧化鋯和二硼化鋯進行化學氣相沉積的最重要的前體。[4]它還被用作紡織品防水劑、皮革鞣劑、分析試劑。[2]
參考文獻
編輯- ^ N. N. Greenwood & A. Earnshaw, Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, Oxford, 1997.
- ^ 2.0 2.1 2.2 2.3 周公度. 《化学辞典》. 北京: 化學工業出版社. 2004. ISBN 7-5025-4409-7.
- ^ Bora U. Zirconium Tetrachloride. Synlett. 2003, (7): 1073–1074. doi:10.1055/s-2003-39323.
- ^ Randich, E. Chemical vapor deposited borides of the form (Ti,Zr)B2 and (Ta,Ti)B2. Thin Solid Films. 1 November 1979, 63 (2): 309–313. doi:10.1016/0040-6090(79)90034-8.