磷霉素
此条目的引用需要清理,使其符合格式。 (2021年7月31日) |
磷霉素是一种主要用于治疗低尿路感染的抗生素,商标名是Monurol,[1]不适用于肾脏感染,[1]偶尔用于治疗前列腺感染。[1]一般口服。[1]
 | |
 | |
| 临床资料 | |
|---|---|
| 商品名 | Monuril, Monurol, others |
| 其他名称 | Phosphomycin, phosphonomycin, fosfomycin tromethamine |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a697008 |
| 给药途径 | 口服 |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 | |
| 药物动力学数据 | |
| 生物利用度 | 30–37% (by mouth, fosfomycin tromethamine); varies with food intake |
| 血浆蛋白结合率 | Nil |
| 药物代谢 | Nil |
| 生物半衰期 | 5.7 小时 (平均) |
| 排泄途径 | 肾和粪便 |
| 识别信息 | |
| |
| CAS号 | 23155-02-4 78964-85-9 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.041.315 |
| 化学信息 | |
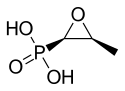
| 化学式 | C3H7O4P |
| 摩尔质量 | 138.06 g·mol−1 |
| 3D模型(JSmol) | |
| 熔点 | 94 °C(201 °F) |
| |
| |
常见的副作用包括腹泻、恶心、头痛和念珠菌性外阴阴道炎。[1] 严重的副作用可能包括过敏反应和伪膜性结肠炎。[1]虽然没有发现妊娠期使用有害,但不推荐这样使用。[2] 母乳喂养期单次服用似乎是安全的。[2] 它通过干扰细菌细胞壁的生成来起作用。[1]
1969年,磷霉素被发现。1996年,它在美国被批准用于医疗。[1][3] 世界卫生组织将磷霉素列为对人类医学至关重要的物质,列入世界卫生组织基本药物清单。[4][5] 它是一种非专利药物。[6] 它最初由某些类型的链球菌生产,现在用化学方法生产。[3]
医疗用途
编辑不建议12岁以下儿童口服磷霉素。[8]
还提出了其他用途。[9] 最近全球抗生素耐药性提高的问题导致了对使用它的新兴趣。[10]
磷霉素可有效治疗尿路感染和复杂性尿路感染(包括急性肾盂肾炎)。复杂尿路感染的标准用药方案是每48或72小时口服一次,每次剂量3克,共3次给药。或者当其以静脉注射形式给药时,每8小时一次,每次6克,持续7至14天。[11]
细菌敏感性
编辑磷霉素抗菌活性广泛,对革兰氏阳性和革兰氏阴性病原菌均有效。对粪肠球菌(E. faecalis)、大肠杆菌(E. coli)以及各种革兰氏阴性菌如柠檬酸杆菌(Citrobacter)和变形杆菌(Proteus)均有较强的抗菌活性。由于在低pH环境中具有较强的活性,并且主要以活性形式排出到尿液中,磷霉素已经被用于预防和治疗这些泌尿系统病原体引起的尿路感染。值得注意的是,它对腐生性链球菌(S. saprophyticus),克雷伯氏菌(Klebsiella)和肠杆菌(Enterobacter)的活性是可变的,应通过最小抑菌浓度检测确认。由于该药物不受交叉耐药问题的影响,所以对产超广谱β-内酰胺酶病原体,特别是产ESBL大肠杆菌的活性是良至优的。现有的临床数据支持其用于易感生物引起的简单型尿路感染。然而,敏感性突变点64毫克/升不应用于全身感染。
抗药性
编辑治疗中经常产生细菌耐药性,使得磷霉素不适用于严重感染的持续治疗。细菌发生突变,非必需甘油磷酸转运蛋白失活,使其对磷霉素产生抗药性。[12][13][14]
将磷霉素与至少另一种活性药物一起使用可降低产生细菌耐药性的风险。磷霉素与许多其他抗生素协同作用,包括头孢菌素、碳青霉烯、达托霉素和氨基糖苷类。[15]
三种相关的磷霉素抗性酶(命名为 FosA、FosB 和 FosX)是乙二醛酶超家族的成员。这些酶通过亲核攻击磷霉素的碳1,打开环氧化物环,使药物无效。
这些酶因反应中使用的亲核试剂的种类而异: FosA为谷胱甘肽,FosB为杆菌硫醇,[17][18]FosX为水。[16]
一般来说,FosA 和 FosX 酶是由革兰氏阴性菌产生的,而 FosB 是由革兰氏阳性菌产生的。[16]
副作用
编辑该药物耐受性良好,有害副作用发生率低。[7]
作用机制
编辑与其名字不同(以-霉素结尾),磷霉素不是一种大环内酯。磷霉素通过灭活UDP-N-乙酰氨基葡萄糖-3- 烯醇丙酮基转移酶抑制细菌细胞壁生物合成。[20] 这种酶催化肽聚糖生物合成的必要步骤:连接磷酸烯醇式丙酮酸(PEP)到UDP-N-乙酰葡萄糖胺的3'-羟基,PEP提供了肽聚糖相互连接的桥接剂。磷霉素是一种PEP 类似物,可以通过烷基化活性部位半胱氨酸残基(大肠杆菌中的Cys115)来抑制MurA。[21][22]
磷霉素通过甘油磷酸转运蛋白进入细菌细胞。[23]
历史
编辑磷霉素(Fosfomycin,原名phosphonomycin)是由默克公司和西班牙的西班牙青霉菌和抗生素公司(CEPA)共同发现的。它首先是通过筛选从土壤样本中分离出来的弗雷迪链霉菌的肉汤培养物来分离的,确定其能够使生长中的细菌形成原生质球。1969年发表的一系列论文描述了这一发现。[24] CEPA于1971年在其阿兰胡埃兹设施开始工业规模生产磷霉素。[25]
生产
编辑从弗氏链霉菌(Streptomyces fradiae)中克隆并测序了磷霉素生物合成基因簇的全序列。由赵惠民和威尔弗雷德 · 范德 · 东克(Wilfred van der Donk)研究小组的赖安 · 伍德尔(Ryan Woodyer)实现了磷霉素在李氏链霉菌(S. lividans)中的异源生产。[26]
参考文献
编辑- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 Fosfomycin Tromethamine Monograph for Professionals. Drugs.com. [29 October 2019]. (原始内容存档于2019-10-29) (英语).
- ^ 2.0 2.1 Fosfomycin (Monurol) Use During Pregnancy. Drugs.com. [29 October 2019]. (原始内容存档于2019-10-29) (英语).
- ^ 3.0 3.1 Antibiotic and Chemotherapy E-Book. Elsevier Health Sciences. 2010: 259 [2021-07-31]. ISBN 9780702047657. (原始内容存档于2021-08-28) (英语).
- ^ World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Critically important antimicrobials for human medicine 6th revision. Geneva: World Health Organization. 2019. ISBN 9789241515528.
- ^ British national formulary : BNF 76 76. Pharmaceutical Press. 2018: 560–561. ISBN 9780857113382.
- ^ 7.0 7.1 Fosfomycin tromethamine. A review of its antibacterial activity, pharmacokinetic properties and therapeutic efficacy as a single-dose oral treatment for acute uncomplicated lower urinary tract infections. Drugs. April 1997, 53 (4): 637–56. PMID 9098664. doi:10.2165/00003495-199753040-00007.
- ^ MONURIL SACHETS 3G. [May 26, 2014]. (原始内容存档于2014-05-28).
- ^ Fosfomycin: use beyond urinary tract and gastrointestinal infections. Clinical Infectious Diseases. April 2008, 46 (7): 1069–77. PMID 18444827. doi:10.1086/527442.
- ^ Potential of old-generation antibiotics to address current need for new antibiotics. Expert Review of Anti-Infective Therapy. October 2008, 6 (5): 593–600. PMID 18847400. doi:10.1586/14787210.6.5.593.
- ^ Oral and Intravenous Fosfomycin for the Treatment of Complicated Urinary Tract Infections. The Canadian Journal of Infectious Diseases & Medical Microbiology (Hindawi Limited). 2020-03-28, 2020: 8513405. PMC 7142339 . PMID 32300381. doi:10.1155/2020/8513405.
- ^ The mechanism of action of fosfomycin (phosphonomycin). Annals of the New York Academy of Sciences. May 1974, 235 (1): 364–86. Bibcode:1974NYASA.235..364K. PMID 4605290. doi:10.1111/j.1749-6632.1974.tb43277.x.
- ^ Molecular Mechanisms and Clinical Impact of Acquired and Intrinsic Fosfomycin Resistance. Antibiotics. April 2013, 2 (2): 217–36. PMC 4790336 . PMID 27029300. doi:10.3390/antibiotics2020217.
- ^ Fosfomycin as Partner Drug for Systemic Infection Management. A Systematic Review of Its Synergistic Properties from In Vitro and In Vivo Studies. Antibiotics. August 2020, 9 (8): 500. PMC 7460049 . PMID 32785114. doi:10.3390/antibiotics9080500.
- ^ 16.0 16.1 16.2 https://archive.org/details/gluthionetransfe00sies/page/367
|chapterurl=缺少标题 (帮助). Gluthione Transferases and Gamma-Glutamyl Transpeptidases. Methods in Enzymology 401. 2005: 367–379. ISBN 9780121828066. PMID 16399398. doi:10.1016/S0076-6879(05)01023-2. - ^ Chemical and Chemoenzymatic syntheses of bacillithiol: a unique low-molecular-weight thiol amongst low G + C Gram-positive bacteria. Angewandte Chemie. July 2011, 50 (31): 7101–4. PMID 21751306. doi:10.1002/anie.201100196.
- ^ Mechanistic studies of FosB: a divalent-metal-dependent bacillithiol-S-transferase that mediates fosfomycin resistance in Staphylococcus aureus. The Biochemical Journal. April 2013, 451 (1): 69–79. PMC 3960972 . PMID 23256780. doi:10.1042/BJ20121541.
- ^ Product of fosC, a gene from Pseudomonas syringae, mediates fosfomycin resistance by using ATP as cosubstrate. Antimicrobial Agents and Chemotherapy. July 1995, 39 (7): 1569–73. PMC 162783 . PMID 7492106. doi:10.1128/aac.39.7.1569.
- ^ MurA (MurZ), the enzyme that catalyzes the first committed step in peptidoglycan biosynthesis, is essential in Escherichia coli. Journal of Bacteriology. July 1995, 177 (14): 4194–7. PMC 177162 . PMID 7608103. doi:10.1128/jb.177.14.4194-4197.1995.
- ^ Functional consequence of covalent reaction of phosphoenolpyruvate with UDP-N-acetylglucosamine 1-carboxyvinyltransferase (MurA). The Journal of Biological Chemistry. April 2012, 287 (16): 12657–67. PMC 3339971 . PMID 22378791. doi:10.1074/jbc.M112.342725.
- ^ Determination of the pKa value of C115 in MurA (UDP-N-acetylglucosamine enolpyruvyltransferase) from Enterobacter cloacae. Biochemistry. October 2000, 39 (41): 12671–7. PMID 11027147. doi:10.1021/bi001310x.
- ^ Interaction of fosfomycin with the glycerol 3-phosphate transporter of Escherichia coli. Biochimica et Biophysica Acta (BBA) - General Subjects. December 2011, 1810 (12): 1323–9. PMID 21791237. doi:10.1016/j.bbagen.2011.07.006.
- ^ Chapter 2, Rational approaches to antibiotic discovery: pre-genomic directed and phenotypic screening. Springer. 2011: 46. ISBN 978-1-4614-1400-1. doi:10.1007/978-1-4614-1400-1_2.
- ^ Encros About us: Our history. 互联网档案馆的存档,存档日期2011-09-14.
- ^ Heterologous production of fosfomycin and identification of the minimal biosynthetic gene cluster. Chemistry & Biology. November 2006, 13 (11): 1171–82. PMID 17113999. doi:10.1016/j.chembiol.2006.09.007.
- ^ Marocco, Christian P.; Davis, Erik V.; Finnell, Julie E.; Nguyen, Phung-Hoang; Mateer, Scott C.; Ghiviriga, Ion; Padgett, Clifford W.; Feske, Brent D. Asymmetric synthesis of (−)-fosfomycin and its trans-(1S,2S)-diastereomer using a biocatalytic reduction as the key step. Tetrahedron: Asymmetry (Elsevier BV). 2011, 22 (18–19): 1784–1789. ISSN 0957-4166. doi:10.1016/j.tetasy.2011.10.009.