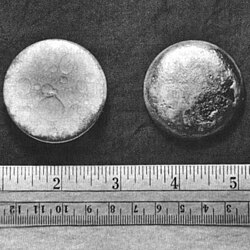
钚
1940年,格伦·西奥多·西博格和埃德温·麦克米伦首度在柏克莱加州大学实验室,以氘撞击铀-238合成出钚元素,是继镎之后第二个被合成出的超铀元素。[2][3]麦克米伦将这个新元素取名Pluto(意为冥王星),西博格便开玩笑提议定其元素符号为Pu(音类似英语中表嫌恶时的口语“pew”)。科学家随后在铀矿中发现了微量的钚,是矿石中的铀-238经过中子俘获紧接着发生两次β衰变而成的:(238U → 239U → 239Np → 239Pu),因此钚是少数存在于自然界中的超铀元素,也是天然存在于自然界中原子序最大的元素。
钚没有稳定同位素,最长寿的同位素是钚-244,半衰期约为八千万年。而工业及军事上最重要的钚同位素是钚-239,半衰期为2.41万年,常被用来制造核武器。[4] 钚-239和钚-241都易于裂变,即它们的原子核可以在慢速热中子撞击下产生核分裂,释出能量、伽马射线以及中子辐射,从而形成核链反应,并应用在核武器与核反应堆上。而钚-240自发裂变的比率很高,容易造成中子通量激增,因而影响了钚作为核武及核燃料的适用性。另外,钚-238的半衰期为88年,衰变时会放出α粒子和大量热能,它是放射性同位素热电机的热量来源,常用于驱动太空船。制造钚的特定同位素时几乎都是以特殊反应合成,分离钚同位素的过程成本极高又耗时费力,因此有些材料只有特定国家在生产。
第二次世界大战期间,曼哈顿计划首度将制造微量钚元素列为主要任务之一,曼哈顿计划后来成功研制出第一个原子弹。1945年7月的第一次核试验“三一试验”,以及第二次、投于长崎市的“胖子原子弹”,都使用了钚制作内核部分。[5]关于钚元素的人体辐射实验研究并在未经受试者同意之下进行,二次大战期间及战后都有数次核试验相关意外,其中有的甚至造成伤亡。核能发电厂核废料的清除,以及冷战期间所打造的核武建设在核武裁减后的费用,都延伸出日后核武器扩散以及环境等问题。非陆上核试验也会释出残余的原子尘,现已依《部分禁止核试验条约》明令禁止。
历史
编辑发现
编辑1934年,恩里科·费米和罗马大学的研究团队发布消息,表示他们发现了元素94[6]。费米将元素取名 hesperium,并曾在他1938年的诺贝尔奖演说中提及[7]。然而,他们的研究成果其实是钡、氪等许多其他元素的混合物,但由于当时核分裂尚未发明,这个误会便一直延续[8]。
1940年12月14日,钚(特别是钚-238)才首度被制造、独立分离出。1941年2月23日,格伦·西奥多·西博格、埃德温·麦克米伦、约瑟夫·肯尼迪和欧亚哲博士在柏克莱加州大学,在一个60英寸(150公分)的回旋加速器中以氘核撞击铀、首度成功地以物理方法得到钚元素[9]。在1940年的实验里,科学家以撞击直接制造出镎-238,但在二天后产生β衰变,后被认定是元素94的形成[10]。
1941年3月,科学家团队将报告寄给《物理评论》杂志[10],但由于发现了新元素的同位素(钚-239)能产生核分裂、往后或许能用于制造原子弹,而在出版前遭到撤回。基于安全因素,报告延迟了一年、直到二次大战结束后才顺利登载[11]。
埃德温·麦克米伦将前发现的超铀元素以行星海王星(Neptune)命名,并提议以冥王星(Pluto)为系列的下一个元素、即元素94取名[12]。西博格原先属意取名“plutium”,但后来认为它的发音不如“plutonium”[13]。他在一次玩笑中选择“Pu”作为元素符号,却在没有被事先通知的情况下,意外被正式纳入元素周期表。西博格亦曾因为误信他们已经找到周期表中最后一个可能存在的元素,而考虑过“ultimium”(意为“最终”)或“extremium”(意为“极度”)等名称。[14]
曼哈顿项目
编辑世界上第一座钚生产堆是1943年3月杜邦公司在橡树岭建设的X-10石墨反应堆及配套的钚化学分离厂。反应堆是边长为7.3 m的立方体,重1,500吨,由厚达2.1 m的高密度混凝土墙构成辐射防护屏障。铀燃料装在铝质外壳的燃料棒内。空气强制冷却。1943年11月3日装入30吨铀后临界运行,功率500至4000 kW,月产钚500毫克。
为了批产钚239,1943年10月10日杜邦公司开始在华盛顿州汉福德区建设大型石墨水冷反应堆。功率25万千瓦。混凝土厂房高37米。计划建造6座反应堆,1944年2月反应堆动工,三座反应堆分别于1944年9月13日、12月17日、1945年2月5日启动。
1944年4月,Emilio Segrè发现反应堆增殖钚的自发裂变率是加速器制造钚的5倍,这是因为前者含有一定量的钚-240,因此不适用枪型原子弹,只能用于内爆原子弹。
冷战的使用与滥用
编辑冷战期间,苏联和美方都密集贮存大量的武器级钚元素。美国在华盛顿州汉福德基地(Hanford Site)和萨凡纳河基地(Savannah River Site)的核反应器便制造了103公吨钚元素[15],俄国估计也有170公吨产量的武器级钚元素[16]。核能工业每年约产出20公吨的副产物钚元素[17]。多达1000公吨的钚受到储存,其中超过200公吨或用于制作、或提炼自核武器之中[10]。斯德哥尔摩国际和平研究所(SIPRI)估计迄2007年全球约有500公吨的钚库存量,平均分配于军用和民用[18]。
医学实验
编辑自二次大战起,曼哈顿计划和其他核武研究计划的科学家便着手研究钚对实验动物及人体的影响[19]。科学家发现,动物组织内只要含达每公斤数毫克的钚就能致死[20]。
人体实验方面,科学家以医院内迈入绝症末期,或因年龄或慢性疾病使预期寿命低于十年的患者为对象,在体内注射五微克剂量的钚溶液[19]。1945年7月,科学家在动物研究发现钚在骨骼中扩散的情形危险程度更甚于镭后,将人体注射剂量改降至一微克[20]。
其中十八名人体实验对象是在非知后同意的情况下被注射钚溶液。人体实验的目的是为了制作测定人体对钚的吸收速度的诊断工具,以订定对钚相关工作的安全标准[19]。
现在人们认为这次事件违反医学伦理和希波克拉底誓词。许多评论者虽认同此举确实违背了信任及道德原则,但“钚物质注射对人体的影响并不像初期新闻故事所描绘的那么严重、有害”,不过“也不像当时和现今科学家所相信的、没有丝毫的负面作用”[21]。
特性
编辑物理性质
编辑钚和多数金属一样具银灰色外表,尤与镍特别相似,但它在氧化后会迅速转为暗灰色(有时呈黄色或橄榄绿),而将其氧化后,会产生一定的热能。[22][23]。钚在室温下以α型存在,是钚元素最普遍的结构型态(同素异形体),质地如铸铁般坚而易脆,但与其他金属制成合金后又变得柔软而富延展性。钚和多数金属不同,它不是热和电的良好导体。它的熔点很低(640 °C),而沸点异常的高(3327 °C)[22]。
钚最普遍释放的电离辐射类型是α粒子发射(即释放出高能的氦原子核)[24]。最典型的一种核子武器核心即是以5公斤(约12.5 × 1024个)钚原子构成。由于钚的半衰期为24,100年,故其每秒约有11.5 × 1012个钚原子产生衰变,发射出5.157 MeV的α粒子,相当于9.68瓦特能量。α粒子的减速会释放出热能,使触摸时感觉温暖[25]。
电阻率是表物质所能抵抗电流流经强度的物理量。钚于室温时的电阻率比一般金属高很多,而且钚和多数金属相反,其电阻率随温度降低而提高[26]。但近期研究指出,当温度降至100K以下时,钚的电阻率会急遽降低[26]。电阻率由于辐射损伤,会在20K之后逐渐提高,速率因同位素结构而异[26]。
钚具有自发辐射性质,使得晶体结构产生疲劳,即原有秩序的原子排列因为辐射而随时间产生紊乱[27]。然而,当温度上升超过100K时,自发辐射也能导致退火,削弱疲劳现象[28]。
钚和多数金属不同:它的密度在熔化时变大(约2.5%),但液态金属的密度又随温度呈线性下降[26]。另外,接近熔点时,钚的液态金属具有很高的黏性和表面张力(相较于其他金属)[27]。
同素异形体
编辑在一般情况下,钚有六种同素异形体,并在高温、限定压力范围下有第七种(ζ)存在[29]。这些同素异形体的内能相近,但拥有截然不同的密度和晶体结构。因此钚对温度、压力以及化学性质的变化十分敏感,各同素异形体的体积并随相变而具有极大差异性[27]。密度因同素异形体而异,范围自16.00 g/cm3到19.86 g/cm3不等[17]。
诸多同素异形体的存在,造成钚的状态易变,使钚元素的制造变得非常困难。例如,α型存在于室温的纯钚中。它和铸铁有许多相似加工后性质,但只要稍微提高温度,便会转成具有可塑性和可锻造性的β型[30]。造成钚复杂相图的背后因素迄今仍未被完整解惑。α型属于低对称性的单斜结构,因此促成它的易碎性、强度、压缩性及低传导性[29]。
化合物与化学性质
编辑室温时,纯钚金属是银灰色、但因氧化而锈蚀[31]。钚在水溶液中形成四种离子氧化态[17]:
- Pu(III) — Pu3+(蓝紫色)
- Pu(IV) — Pu4+(黄棕色)
- Pu(V) — PuO2+(粉红色?)[注 1]
- Pu(VI) — PuO22+(粉桔色)
- Pu(VII) — PuO53−(绿色)–七价离子较稀有
钚溶液所呈现的颜色决定于氧化态和酸阴离子的性质[32]。钚的酸阴离子种类影响了错合(原子与中心原子结合)的程度。
核分裂
编辑钚是一种具放射性的锕系元素。它的5f电子是离域和定域之间的过渡界线;钚因此常被认为是最复杂的元素之一[33]。它的同位素钚-239是三个最重要的易裂变同位素之一(另外二者为铀-233和铀-235)[34];钚-241也具有高度易裂变性。所谓的具“易裂变性”(fissile),是指同位素的原子核受到慢中子撞击后,能够产生核分裂,并另释放出足以支持核链反应、进一步促使原子核分裂的中子。
同位素
编辑钚有二十种已知的同位素,全部都具有放射性。其中寿命最长的是钚-244(半衰期为8080万年),也是所有超铀元素中半衰期最长的核素。其他较长寿的同位素有钚-242(半衰期为373300年)及钚-239(半衰期为24110年)。其余的放射性同位素半衰期都低于7000年。钚也有八种同核异构体,但并不稳定、半衰期都不超过一秒[24]。钚-244存在于太空中。[35]
已知的钚同位素的质量数范围从228到247不等。其中质量数低于钚-244(最稳定的钚同位素)的同位素,主要的衰变方式是自发裂变和α衰变,衰变产物通常生成铀(92个质子)和镎(93个质子)的同位素(忽略裂变过程产生之二子核的大范围)。质量数大于钚-244的同位素则以β衰变为主要衰变方式,衰变产物多为镅(95个质子)。钚-241是镎衰变系的母同位素,透过β衰变变成镅-241。[24][36]。
钚-238和钚-239是最常用的人造同位素[12]。钚-239是用中子轰击铀,透过下列反应合成的[37]:
铀-235裂变中的中子被铀-238原子核俘获、形成铀-239;β衰变将一个中子转变成质子,形成镎-239(半衰期为2.36日),另一次β衰变则形成钚-239[38]。合金管工程的学者曾在1940年推导出此反应式。
钚-238是以氘核(D,重氢的原子核)撞击铀-238,透过下列反应合成[39]:
在此反应过程中,一个氘核撞击铀-238,生成两个中子和镎-238;镎-238再发射β-粒子,形成钚-238。[40]钚-238也可以由镎-237中子活化而成。[41]
衰变热与裂变性质
编辑钚同位素会发生放射性衰变,释放出衰变热。不同的同位素,单位质量所释出的热量也有所差异。衰变热的单位通常以“瓦特/公斤”或“毫瓦特/公克”计。所有同位素在衰变时都会释放出微弱的伽马射线。
| 同位素 | 衰变方式 | 半衰期(年) | 衰变热(W/kg) | 自发裂变中子(1/(g·s)) | 简介 |
|---|---|---|---|---|---|
| 钚-238 | α衰变成为铀-234 | 87.74 | 560 | 2600 | 衰变热极高。即使量少也能显著自燃。使用于放射性同位素热电机。 |
| 钚-239 | α衰变成为铀-235 | 24100 | 1.9 | 0.022 | 现最主要使用的易裂变同位素。 |
| 钚-240 | α衰变成为铀-236 自发裂变 |
6560 | 6.8 | 910 | 钚-239同位素的主要杂质。 |
| 钚-241 | β衰变成为镅-241 | 14.4 | 4.2 | 0.049 | 衰变成为镅-241;辐射危害的早期研究对象。 |
| 钚-242 | α衰变成为铀-238 | 376000 | 0.1 | 1700 |
存量
编辑钚是天然存在于自然界中原子序最大的元素。在自然界中可以找到痕量的钚-238、钚-239、钚-240和钚-244。钚-239是铀矿中的铀-238经过中子俘获紧接着发生两次β衰变而成的:(238U → 239U → 239Np → 239Pu)[43][44]。铀矿中可能还含有极少量的钚-238,为铀-238极其罕见地发生双β衰变所产生(几率只有2.19×10−10%),科学家目前已在天然铀矿石样本中检测到其存在。[45]
由于其相对较长的半衰期(约 8000 万年),有人认为钚-244 作为原始核素 自然存在,但其检测的早期报告无法得到证实。[46]然而,它的长半衰期确保了它在灭绝之前在整个太阳系中循环,[47] 事实上,已经在陨石中发现了灭绝的244Pu自发裂变的证据。[48] 244Pu 在早期太阳系中的存在已得到证实,因为它今天表现为其子体的过量,即 232Th (来自α衰变途径)或氙同位素(来自其自发裂变)。 后者通常更有用,因为钍和钚的化学性质非常相似(两者主要都是四价),因此过量的钍并不能有力地证明其中一些钚是作为钚子体形成的。[49] 244Pu 是所有超铀核素中半衰期最长的,仅在 超新星e 和碰撞 中子星 的 r 过程 中产生; 当原子核从这些事件中高速喷射到地球时,244超铀核素中只有钚有足够长的半衰期,可以在整个旅程中存活下来,因此会留下微小的生命星际痕迹244 在深海海底发现了Pu。 由于240Pu也出现在244Pu的衰变链中,因此它也必定存在于长期平衡中,尽管数量更小 。[50]
由于已经进行了550次大气和水下核试验,以及少数重大核事故,人体中通常会发现微量钚痕迹。1963 年,美国、英国、苏联和其他国家签署并批准了《有限禁止核试验条约》,停止了大多数大气层和水下核试验。 非条约国家自 1963 年以来持续进行的大气层核武器试验包括中国的试验(1964 年在戈壁沙漠上空进行原子弹试验,1967 年氢弹试验,以及 后续测试)和法国(最近于 20 世纪 90 年代进行测试)。 由于钚239是专门为核武器和核反应堆制造的,因此它是迄今为止最丰富的钚同位素。[51]
应用
编辑原子弹
编辑同位素钚-239是核武器中最重要的裂变成分。将钚核置入反射体(质量数大的物质的反射层)中,能使逃逸的中子再反射回弹心,减少中子的损失,进而降低钚达到临界质量的标准量:从原需16公斤的钚,可减少至10公斤,即一个直径约10公分的球体的量[52]。它的临界质量约仅有铀-235的三分之一[12]。
曼哈顿计划期间制造的“胖子原子弹”型钚弹,为了达到极高的密度而选择使用易爆炸、压缩的钚,再结合中心中子源,以刺激反应进行、提高反应效率。因此,钚弹只需6.2公斤钚便可达到爆炸当量,相当于2万吨的三硝基甲苯(TNT)[53][54](参见核武器设计)。在理想假设中,仅仅4公斤的钚原料(甚至更少),只要搭配复杂的装配设计,就可制造出一个原子弹[54]。
核燃料
编辑钚-239常用作核反应堆的核燃料。钚-239可以在反应堆内合成,是人造易分裂元素,其临界质量比铀小,在有水的情况下,650克的钚即可发生临界事故。金属态的钚较脆弱,熔点低(640℃);从室温到熔点有六种同素异形体,结构变化复杂;导热系数低,仅为铀的1/6左右;线膨胀系数大,各向异性十分明显;化学稳定性很差,并极易氧化,易与氢气和二氧化碳发生反应。这些缺点使金属态的钚不适合作为核燃料,一般都以氧化物的形式与氧化铀混合使用,即混合氧化物燃料。这种钚与铀的组合可以实现快中子增殖,因而成为当今着重研究的核燃料之一。
核废料
编辑一般轻水反应堆所产生的核废料中含有钚,但为钚-242、钚-239和钚-238的混合物。它的浓度不足以制作成核武器,不过可以改用作一次性的混氧燃料(MOX fuel)。在反应堆中以慢速热中子放射线照射钚时,会偶然发生中子俘获,而增加钚-242和钚-240的量。因此反应进行到第二轮之后,钚只能和快中子反应堆反应、消耗。在反应器中没有快中子时(普遍情况下),剩余的钚通常会被遗弃,形成寿命长、处理棘手的核废料成分。
能源与热源
编辑同位素钚-238的半衰期为87.74年[55]。它会放出大量热能,伴随着低能的伽马和自发裂变射线/粒子[56]。它是α辐射体,同时具有高辐射能及低穿透性,故仅需低度防护措施。单一纸张就可以抵挡钚-238所放射出的α粒子;同时,每公斤的钚-238可产生约570瓦特热能[12][56]。以上特性使钚-238适宜用于制作放射性同位素热电机。
谣传
编辑中国大陆百科网站百度百科曾经谣传只要约一粒方糖大小(约5克)的钚便足以令全球人类死亡。香港无线电视的新闻节目曾引用此谣传,结果被广播事务管理局警告,指报道令观众惊恐,未有提供足够证据确保报道准确[57]。
参见
编辑注释
编辑- ^ PuO2+离子在溶液中十分不稳定,所占比例不比Pu4+和PuO22+;Pu4+又会将剩余PuO2+氧化成PuO22+,自身还原为Pu3+。因此,钚水溶液会渐渐趋向Pu3+ 和PuO22+的混合溶液。
- Crooks, William J. Nuclear Criticality Safety Engineering Training Module 10 – Criticality Safety in Material Processing Operations, Part 1 (PDF). 2002 [2006-02-15]. (原始内容 (PDF)存档于2006-03-20).
参考资料
编辑- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Yang, Sarah. Historic plutonium sample traced to Seaborg, Manhattan Project. Berkeley News. 2015-01-16 [2019-07-21]. (原始内容存档于2021-05-16) (美国英语).
- ^ University of California, Berkeley. Atomic Heritage Foundation. [2019-07-21]. (原始内容存档于2021-05-12) (英语).
- ^ 'Detection of Plutonium-244 in Nature,' Nature 234, 132-134 (19 November 1971). [2010-09-17]. (原始内容 (PDF)存档于2016-03-03).
- ^ Little Boy and Fat Man. Atomic Heritage Foundation. [2019-07-21]. (原始内容存档于2017-12-24) (英语).
- ^ Holden, Norman E. A Short History of Nuclear Data and Its Evaluation. 51st Meeting of the USDOE Cross Section Evaluation Working Group. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. 2001 [2009-01-03]. (原始内容存档于2017-11-08).
- ^ Fermi, Enrico. Artificial radioactivity produced by neutron bombardment: Nobel Lecture (PDF). Royal Swedish Academy of Sciences. 1938-12-12 [2010-09-20]. (原始内容 (PDF)存档于2011-08-05).
- ^ Darden, Lindley. Enrico Fermi: "Transuranium" Elements, Slow Neutrons. The Nature of Scientific Inquiry. College Park (MD): Department of Philosophy, University of Maryland. 1998 [2008-01-03]. (原始内容存档于2012-08-17).
- ^ LBNL contributors. Elements 93 and 94. Advanced Computing for Science Department, Lawrence Berkeley National Laboratory. [2008-09-17]. (原始内容存档于2008-09-20).
- ^ 10.0 10.1 10.2 Emsley 2001
- ^ Stwertka 1998
- ^ 12.0 12.1 12.2 12.3 Heiserman 1992,第338页.
- ^ Clark, David L.; Hobart, David E. Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912–1999 (PDF). Los Alamos Science. 2000, 26: 56–61, on 57 [2009-02-15]. (原始内容 (PDF)存档于2011-06-04).
- ^ PBS contributors. Frontline interview with Seaborg. Frontline. Public Broadcasting Service. 1997 [2008-12-07]. (原始内容存档于2009-01-05).
- ^ DOE contributors. Historic American Engineering Record: B Reactor (105-B Building). Richland (WA): U.S. Department of Energy. 2001: 110 [2008-12-24]. DOE/RL-2001-16. (原始内容存档于2021-03-07).
- ^ Cochran, Thomas B. Safeguarding nuclear weapons-usable materials in Russia (PDF). International Forum on Illegal Nuclear Traffic. Washington (DC): Natural Resources Defense Council, Inc. 1997 [2008-12-21]. (原始内容 (PDF)存档于2013-07-05).
- ^ 17.0 17.1 17.2 CRC 2006,第4–27页
- ^ Stockholm International Peace Research Institute. SIPRI Yearbook 2007: Armaments, Disarmament, and International Security. Oxford University Press. 2007: 567. ISBN 9780199230211.
- ^ 19.0 19.1 19.2 Moss, William; Eckhardt, Roger. The Human Plutonium Injection Experiments (PDF). Los Alamos Science (Los Alamos National Laboratory). 1995, 23: 188, 205, 208, 214 [2006-06-06]. (原始内容 (PDF)存档于2021-02-20).
- ^ 20.0 20.1 Voelz, George L. Plutonium and Health: How great is the risk?. Los Alamos Science (Los Alamos (NM): Los Alamos National Laboratory). 2000, (26): 78–79.
- ^ Yesley, Michael S. 'Ethical Harm' and the Plutonium Injection Experiments (PDF). Los Alamos Science. 1995, 23: 280–283 [2009-02-15]. (原始内容 (PDF)存档于2021-03-27).
- ^ 22.0 22.1 NIH contributors. Plutonium, Radioactive. Wireless Information System for Emergency Responders (WISER). Bethesda (MD): U.S. National Library of Medicine, National Institutes of Health. [2008-11-23]. (原始内容存档于2011-08-22). (public domain text)
- ^ ARQ staff. Nitric acid processing. Actinide Research Quarterly (Los Alamos (NM): Los Alamos National Laboratory). 2008, (3rd quarter) [2010-02-09]. (原始内容存档于2010-05-27).
While plutonium dioxide is normally olive green, samples can be various colors. It is generally believed that the color is a function of chemical purity, stoichiometry, particle size, and method of preparation, although the color resulting from a given preparation method is not always reproducible.
- ^ 24.0 24.1 24.2 NNDC contributors; Alejandro A. Sonzogni (Database Manager). Chart of Nuclides. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. 2008 [2008-09-13]. (原始内容存档于2011-07-21).
- ^ Rhodes, Richard. The Making of the Atomic Bomb. New York: Simon & Schuster. 1986: 659–660. ISBN 0-671-65719-4. Leona Marshall: "When you hold a lump of it in your hand, it feels warm, like a live rabbit"
- ^ 26.0 26.1 26.2 26.3 Miner 1968,第544页
- ^ 27.0 27.1 27.2 Hecker, Siegfried S. Plutonium and its alloys: from atoms to microstructure (PDF). Los Alamos Science. 2000, 26: 290–335 [2009-02-15]. (原始内容 (PDF)存档于2021-03-19).
- ^ Hecker, Siegfried S.; Martz, Joseph C. Aging of Plutonium and Its Alloys (PDF). Los Alamos Science (Los Alamos, New Mexico: Los Alamos National Laboratory). 2000, (26): 242 [2009-02-15]. (原始内容 (PDF)存档于2021-04-28).
- ^ 29.0 29.1 29.2 Baker, Richard D.; Hecker, Siegfried S.; Harbur, Delbert R. Plutonium: A Wartime Nightmare but a Metallurgist's Dream (PDF). Los Alamos Science (Los Alamos National Laboratory). 1983: 148, 150–151 [2009-02-15]. (原始内容 (PDF)存档于2011-10-17).
- ^ Miner 1968,第542页
- ^ Heiserman 1992,第339页.
- ^ Matlack, George. A Plutonium Primer: An Introduction to Plutonium Chemistry and its Radioactivity. Los Alamos National Laboratory. 2002 [2024-09-04]. LA-UR-02-6594. (原始内容存档于2024-09-04).
- ^ Dumé, Belle. Plutonium is also a superconductor. PhysicsWeb.org. 2002-11-20 [2010-09-18]. (原始内容存档于2012-01-12).
- ^ EPA contributors. Fissile Material. Radiation Glossary. United States Environmental Protection Agency. 2008 [2008-11-23]. (原始内容存档于2011-07-20).
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steier, P. Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis. Nature Communications. 2015, 6: 5956. Bibcode:2015NatCo...6.5956W. ISSN 2041-1723. PMC 4309418 . PMID 25601158. arXiv:1509.08054 . doi:10.1038/ncomms6956.
- ^ Heiserman 1992,第340页.
- ^ Kennedy, J. W.; Seaborg, G. T.; Segrè, E.; Wahl, A. C. Properties of Element 94. Physical Review. 1946, 70 (7–8): 555–556. doi:10.1103/PhysRev.70.555.
- ^ Greenwood 1997,第1259页
- ^ Seaborg, Glenn T.; McMillan, E.; Kennedy, J. W.; Wahl, A. C. Radioactive Element 94 from Deuterons on Uranium. Physical Review. 1946, 69 (7–8): 366–367. doi:10.1103/PhysRev.69.367.
- ^ Bernstein 2007,第76–77页.
- ^ Miotla, Dennis. Assessment of Plutonium-238 Production of Alternatives: Briefing for Nuclear Energy Advisory Committee (PDF). Energy.gov. 21 April 2008 [28 February 2022]. (原始内容存档 (PDF)于March 16, 2022).
- ^ Can Reactor Grade Plutonium Produce Nuclear Fission Weapons?. Council for Nuclear Fuel Cycle Institute for Energy Economics, Japan. May 2001 [2010-09-19]. (原始内容存档于2021-02-24).
- ^ Bernstein 2007,第75–77页.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. Detection of Plutonium-244 in Nature. Nature. 1971, 234 (5325): 132–134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0.
- ^ Peterson, Ivars. Uranium displays rare type of radioactivity. Science News (Wiley-Blackwell). December 7, 1991, 140 (23): 373. JSTOR 3976137. doi:10.2307/3976137.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. Detection of Plutonium-244 in Nature. Nature. 1971, 234 (5325): 132–134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0. Nr. 34.
- ^ Turner, Grenville; Harrison, T. Mark; Holland, Greg; Mojzsis, Stephen J.; Gilmour, Jamie. Extinct 244Pu in Ancient Zircons (PDF). Science. 2004-01-01, 306 (5693): 89–91. Bibcode:2004Sci...306...89T. JSTOR 3839259. PMID 15459384. doi:10.1126/science.1101014. (原始内容 (PDF)存档于2020-02-11).
- ^ Hutcheon, I. D.; Price, P. B. Plutonium-244 Fission Tracks: Evidence in a Lunar Rock 3.95 Billion Years Old. Science. 1972-01-01, 176 (4037): 909–911. Bibcode:1972Sci...176..909H. JSTOR 1733798. PMID 17829301. doi:10.1126/science.176.4037.909.
- ^ Kunz, Joachim; Staudacher, Thomas; Allègre, Claude J. Plutonium-Fission Xenon Found in Earth's Mantle. Science. 1998-01-01, 280 (5365): 877–880. Bibcode:1998Sci...280..877K. JSTOR 2896480. doi:10.1126/science.280.5365.877.
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steiner, P. Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis. Nature Communications. 30 March 2014, 6: 5956. Bibcode:2015NatCo...6E5956W. arXiv:1509.08054 . doi:10.1038/ncomms6956.
- ^ Emsley 2001,第324–329页
- ^ Martin, James E. Physics for Radiation Protection 1st. Wiley-Interscience. 2000: 532. ISBN 0471353736.
- ^ Malik, John. The Yields of the Hiroshima and Nagasaki Explosions (PDF). Los Alamos. September 1985: Table VI [2009-02-15]. LA-8819. (原始内容 (PDF)存档于2021-03-14).
- ^ 54.0 54.1 FAS contributors. Nuclear Weapon Design. Federation of American Scientists. 1998 [2008-12-07]. (原始内容存档于2016-08-28).
- ^ Science for the Critical Masses: How Plutonium Changes with Time. Institute for Energy and Environmental Research. [2010-10-02]. (原始内容存档于2012-02-14).
- ^ 56.0 56.1 ARQ contributors. From heat sources to heart sources: Los Alamos made material for plutonium-powered pumper. Actinide Research Quarterly (Los Alamos (NM): Los Alamos National Laboratory). 2005, (1) [2009-02-15]. (原始内容存档于2013-02-16).
- ^ 错报核新闻 无线遭警告[失效链接],《明报》,2011年10月4日
<references>标签中name属性为“FOOTNOTEHeiserman1992338”的参考文献没有在文中使用参考书目
编辑- CRC contributors. David R. Lide , 编. Handbook of Chemistry and Physics 87th. Boca Raton (FL): CRC Press, Taylor & Francis Group. 2006. ISBN 0849304873.
- Emsley, John. Plutonium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford (UK): Oxford University Press. 2001: 324–329. ISBN 0198503407.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford (UK): Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Heiserman, David L. Element 94: Plutonium. Exploring Chemical Elements and their Compounds. New York (NY): TAB Books. 1992: 337–340. ISBN 0-8306-3018-X.
- Miner, William N.; Schonfeld, Fred W. Plutonium. Clifford A. Hampel (editor) (编). The Encyclopedia of the Chemical Elements. New York (NY): Reinhold Book Corporation. 1968: 540–546. LCCN 68-29938.
- Stwertka, Albert. Plutonium. Guide to the Elements Revised. Oxford (UK): Oxford University Press. 1998. ISBN 0-19-508083-1.
外部链接
编辑- 元素钚在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钚(英文)
- 元素钚在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钚在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钚(英文)
- Sutcliffe, W.G.; et al. A Perspective on the Dangers of Plutonium. Lawrence Livermore National Laboratory. 1995. (原始内容存档于2006-09-29).
- Johnson, C.M.; Davis, Z.S. Nuclear Weapons: Disposal Options for Surplus Weapons-Usable Plutonium. CRS Report for Congress # 97-564 ENR. 1997 [2009-02-15]. (原始内容存档于2021-03-07).
- IEER contributors. Physical, Nuclear, and Chemical, Properties of Plutonium. IEER. 2005 [2009-02-15]. (原始内容存档于2011-08-05).
- Bhadeshia, H. Plutonium crystallography. [2010-09-19]. (原始内容存档于2018-05-08).
- Samuels, D. End of the Plutonium Age. Discover Magazine. 2005, 26 (11) [2010-09-19]. (原始内容存档于2011-11-08).
- Pike, J.; Sherman, R. Plutonium production. Federation of American Scientists. 2000 [2009-02-15]. (原始内容存档于2009-02-03).
- Nuclear Weapon Archive contributors. Plutonium Manufacture and Fabrication. Nuclearweaponarchive.org.
- Ong, C. World Plutonium Inventories. Nuclear Files.org. 1999 [2009-02-15]. (原始内容存档于2011-06-21).
- LANL contributors. Challenges in Plutonium Science. Los Alamos Science. 2000, I & II (26) [2009-02-15]. (原始内容存档于2017-01-18).
- NLM contributors. Plutonium, Radioactive. NLM Hazardous Substances Databank. [2009-02-15]. (原始内容存档于2016-01-12).
- Alsos contributors. Annotated Bibliography on plutonium. Alsos Digital Library for Nuclear Issues. [2009-02-15]. (原始内容存档于2009-02-03).
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Plutonium (页面存档备份,存于互联网档案馆)