用户:二氯卡宾/1
此条目需要扩充。 (2008年4月13日) |
| 香草醛 | |
|---|---|
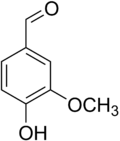
| |

| |
| IUPAC名 4-Hydroxy-3-methoxybenzaldehyde | |
| 别名 | 香兰素 Vanillic aldehyde Methyl vanillin |
| 识别 | |
| CAS号 | 121-33-5 |
| PubChem | 1183 |
| ChemSpider | 13860434 |
| SMILES |
|
| InChI |
|
| InChIKey | MWOOGOJBHIARFG-UHFFFAOYAS |
| Beilstein | 472792 |
| Gmelin | 3596 |
| 3DMet | B00167 |
| EINECS | 204-465-2 |
| ChEBI | 18346 |
| RTECS | YW5775000 |
| KEGG | D00091 |
| MeSH | vanillin |
| IUPHAR配体 | 6412 |
| 性质 | |
| 化学式 | C8H8O3 |
| 摩尔质量 | 152.15 g·mol⁻¹ |
| 外观 | 白色至微黄色固体 (针状晶体) |
| 气味 | 具有香草香气,呈甜味、奶香、令人愉悦的气味 |
| 密度 | 1.056 [1]g·cm-3 |
| 熔点 | 80—81 °C(353—354 K)[2] |
| 沸点 | 285°C (558 K) [1] |
| 溶解性(水) | 1 g/100 ml (25°C) |
| log P | 1.208 |
| 黏度 | ? cP(?°C) |
| 危险性 | |
| 警示术语 | R:R22 |
| 安全术语 | S:S24/25 |
| MSDS | 英文MSDS |
| GHS提示词 | WARNING |
| H-术语 | H302, H317, H319 |
| P-术语 | P280, P305+351+338 |
| 主要危害 | 可能对皮肤、眼部和呼吸系统造成刺激 |
| NFPA 704 | |
| 闪点 | 147°C |
| 相关物质 | |
| 相关化学品 | 丁香酚、茴香醛、苯酚 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
香草醛(英语:Vanillin,通称香兰素),是一种白色至微黄色针状结晶的酚醛,化学式为C8H8O3,官能团包含醛基、羟基和醚键。香草醛是香荚兰豆的天然提取物主要成分,是重要的食用香料之一。现今人工合成的香草醛被广泛应用于食品、饮料和医药领域的调香。
乙基香兰素的香气强度和留香时间都强于香兰素,是一种重要的人工合成香料。最初香草醛由天然原料丁香油中的丁香油酚出发合成,而今更经济的选择是制浆产业中的木质素法,或是以石油化工前体的愈创木酚和乙醛酸为原料的路线。据称,木质素法的合成香草素有更丰富的风味层次,而产生差异的原因是香草乙酮。[3][注 1]
历史
编辑尽管普遍认为香草是在中美洲被驯化的,随后在16世纪传播到旧大陆,但在2019年发表的一篇论文指出,在以色列一座古墓中的罐子里发现了香兰素残留物,其年代可追溯到公元前两千年。这表明自中期青铜时代以来,迦南可能种植了一种尚未确认、旧大陆特有的香草物种。[4][5]在耶路撒冷的酒罐中也发现了香兰素的痕迹,这些酒罐被认为是犹大族权贵在耶路撒冷之围前的公元前 586 年所使用的。[5]
香荚兰豆是中美洲原住民发现和种植的饮料调味品(阿兹特克人称为tlilxochitl),其中最著名的是现代墨西哥韦拉克鲁斯州的托托纳克人。最晚自 15 世纪初开始,阿兹特克人就在名为 "xocohotl "的饮料中使用香草作为巧克力的调料。[6]
1858 年泰奥多尔·尼古拉斯·高布利首次分离出相对纯净的香兰素,他将香草提取液蒸干,然后重结晶得到固体。[7]1874 年,德国科学家费迪南德·悌曼和威廉·哈曼推断出了它的化学结构,同时发现了从松柏苷(一种从松柏树皮中发现的异丁香油酚的葡萄糖苷)合成香兰素的路线。[8]悌曼和哈曼成立了哈曼·雷默公司(现为德之馨的一部分),并在霍尔茨明登利用他们的工艺(即Reimer–Tiemann反应)开始了香兰素的首次工业生产。1876 年,卡尔·雷默首次用愈创木酚(1)合成了香兰素(2)。[9]
到 19 世纪末,从丁香油中的丁香油酚衍生的半合成香兰素已经可以在市场上买到。[10][注 2]合成香兰素在1930年代变得更普及,彼时丁香油法香兰素被从造纸业制备木浆的亚硫酸盐制浆法所产生的废液中的木质素法合成香兰素所取代。在1981 年,索罗尔德的一家纸浆造纸企业供应了全球 60% 的合成香兰素市场。[11]然而,木浆工业随后的发展使木质素废料作为合成香兰素原料的竞争力下降。如今,全球生产的香兰素中只有约 15% 是用木质素废料制成的[12] ,而约 85% 是通过两步法从石油化工前体愈创木酚和乙醛酸合成的。[13][14]
分布
编辑香兰素是香草中最主要的风味来源,风干的香草荚中含有约2% 的香兰素。在品质优良的干豆荚上,相对纯净的香兰素可能会以白色粉末或“霜”的形式挂在豆荚表面。原产于巴拉圭和巴西南部的一种筒叶兰香钗兰[15]和中国油松中也有香兰素。
在低浓度下,香兰素可为橄榄油 [16]、黄油 [17] 、树莓 [18] 和荔枝[19]等许多食品增添香气。橡木桶陈酿会赋予一些葡萄酒、醋 [20]和烈酒[21]香兰素的香气。
在其他食品中,加热可能会由其他化合物产生香兰素,并为其提供香草的风味和香气,比如咖啡[22][16]、枫糖[23]和全谷产品(包括墨西哥薄饼 [24]和燕麦片[25])。
化学性质
编辑天然产物
编辑从香荚兰(一种原产于墨西哥的藤本兰花,现已在全球热带地区培植)种荚中可提取出天然香兰素。
收获时,种荚中的天然香兰素以香草醛葡萄糖苷形式存在,是一类β-D-葡萄糖苷;荚果本身没有香草的气味。[26]在成熟[27][28]和风干[29]过程中,香兰素在β-葡萄糖苷酶的作用下从葡萄糖香兰素中被释放出来。
生物合成
编辑尽管目前尚不明确香荚兰中香兰素生物合成的确切途径,但一般认为香兰素的生物合成是苯丙烷类途径的一部分,从L-苯丙氨酸开始[30],通过苯丙氨酸氨裂合酶(PAL)脱氨形成 反式肉桂酸。然后,该环的对位被细胞色素P450酶/肉桂酸4-羟化酶(C4H/P450)羟基化,生成对香豆酸 [31]。然后,在拟定的阿魏酸酯途径中,4-香豆酰辅酶A连接酶(4CL)将对香豆酸连接到辅酶A(CoA)上,得到对香豆酰辅酶A。然后,羟基肉桂酰基转移酶(HCT)将4-香豆酰辅酶A转化为 4-香豆酰莽草酸酯/奎尼酸酯。随后,香豆酰酯 3'-羟化酶(C3'H/P450)将其氧化,生成咖啡酰莽草酸酯/奎尼酸酯。然后,HCT 催化莽草酸酯/奎尼酸酯与辅酶A交换,得到咖啡酰辅酶A,随后用4CL脱去辅酶A,生成咖啡酸。然后,咖啡酸通过咖啡酸-O-甲基转移酶(COMT)进行甲基化,生成阿魏酸。最后,香兰素合成水合酶/裂解酶(vp/VAN)催化水合阿魏酸中的双键,紧接着逆羟醛反应,生成香兰素[31]。香兰素也可以通过去糖基化由葡萄糖香兰素生成[26]。旧时,对羟基苯甲醛被猜测为香兰素的生物合成前体。然而,2014 年一项使用了放射性标记前体的研究表明,香荚兰中的香兰素或葡萄糖香兰素生物合成并未使用对羟基苯甲醛。[31]
用途
编辑可用于食品生产中,具有配制食用香精的作用,同时也可用于医药、日化、电镀、饲料等其他方面。
贮存
编辑在阴凉、干燥、避光和的通风室内处贮存,需防止日晒雨淋。
制作方法
编辑把香草荚剖开取出香草籽,再和剪成小段的香草荚枝干一起浸泡在40度以上的酒中(一般可以选取白朗姆酒/伏特加等),浸泡3个月左右。
参考文献
编辑- ^ 1.0 1.1 Haynes, William M. (编). CRC Handbook of Chemistry and Physics 97th. CRC Press. 2016: 3.310. ISBN 978-1-4987-5429-3.
- ^ Rosenmund, K. W.; Weiler, G. Catalytic reduction of acid chlorides VI. Preparation of unsaturated aldehydes. Berichte der Deutschen Chemischen Gesellschaft [Abteilung] B: Abhandlungen, 1923. 56B. 1481-1487. ISSN: 0365-9488.
- ^ Esposito, Lawrence J.; K. Formanek; G. Kientz; F. Mauger; V. Maureaux; G. Robert; F. Truchet. Vanillin. Kirk-Othmer Encyclopedia of Chemical Technology, 4th edition 24. New York: John Wiley & Sons: 812–825. 1997. ISBN 978-0-471-52693-3.
- ^ Linares, V.; Adams, M. J.; Cradic, M. S.; Finkelstein, I.; Lipschits, O.; Martin, M. A. S.; Neumann, R.; Stockhammer, P. W.; Gadot, Y. First evidence for vanillin in the old world: Its use as mortuary offering in Middle Bronze Canaan. Journal of Archaeological Science: Reports. June 2019, 25: 77–84. Bibcode:2019JArSR..25...77L. S2CID 181608839. doi:10.1016/j.jasrep.2019.03.034.
- ^ 5.0 5.1 Amir, A.; Finkelstein, I.; Shalev, Y.; Uziel, J.; Chalaf, O.; Freud, L.; Neumann, R.; Gadot, Y. Amir A, Finkelstein I, Shalev Y, Uziel J, Chalaf O, Freud L, et al. (2022) Residue analysis evidence for wine enriched with vanilla consumed in Jerusalem on the eve of the Babylonian destruction in 586 BCE. PLoS ONE 17(3). PLOS ONE. 2022, 17 (3): e0266085. PMC 8963535 . PMID 35349581. doi:10.1371/journal.pone.0266085 .
- ^ MexicanVanilla.com. Mexican Vanilla - A History. MexicanVanilla.com. [2022-06-14] (英语).
- ^ Gobley, M. Recherches sur le principe odorant de la vanille. Journal de Pharmacie et de Chimie. 1858, 34: 401–405.
- ^ Tiemann, Ferd.; Wilh. Haarmann. Ueber das Coniferin und seine Umwandlung in das aromatische Princip der Vanille. Berichte der Deutschen Chemischen Gesellschaft. 1874, 7 (1): 608–623. doi:10.1002/cber.187400701193.
- ^ Reimer, Karl Ludwig. Ueber eine neue Bildungsweise aromatischer Aldehyde. Berichte der Deutschen Chemischen Gesellschaft. 1876, 9 (1): 423–424. doi:10.1002/cber.187600901134.
- ^ Hocking, Martin B. Vanillin: Synthetic Flavoring from Spent Sulfite Liquor (PDF). Journal of Chemical Education. September 1997, 74 (9): 1055–1059 [2006-09-09]. Bibcode:1997JChEd..74.1055H. doi:10.1021/ed074p1055.
- ^ Hocking 1997.
- ^ Fache, Maxence; Boutevin, Bernard; Caillol, Sylvain. Vanillin Production from Lignin and Its Use as a Renewable Chemical. ACS Sustain. Chem. Eng. 2015, 4 (1): 35–46. doi:10.1021/acssuschemeng.5b01344.
- ^ Esposito 1997.
- ^ Kamlet, Jonas & Mathieson, Olin. Manufacture of vanillin and its homologues U.S. Patent 2,640,083 (PDF). U.S. Patent Office. 1953.
- ^ Leptotes bicolor. Flora Library. [2011-08-21].
- ^ 16.0 16.1 Brenes, Manuel; Aranzazu García; Pedro García; José J. Rios; Antonio Garrido. Phenolic Compounds in Spanish Olive Oils. Journal of Agricultural and Food Chemistry. 1999, 47 (9): 3535–3540. PMID 10552681. doi:10.1021/jf990009o.
- ^ Vreuls, René J. J.; van der Heijden, Arnold; Brinkman, Udo A. Th.; Adahchour, Mohamed. Trace-level determination of polar flavour compounds in butter by solid-phase extraction and gas chromatography–mass spectrometry. Journal of Chromatography A. 1999, 844 (1–2): 295–305. PMID 10399332. doi:10.1016/S0021-9673(99)00351-9.
- ^ Roberts, Deborah D.; Terry E. Acree. Effects of Heating and Cream Addition on Fresh Raspberry Aroma Using a Retronasal Aroma Simulator and Gas Chromatography Olfactometry. Journal of Agricultural and Food Chemistry. 1996, 44 (12): 3919–3925. doi:10.1021/jf950701t.
- ^ Ong, Peter K. C.; Terry E. Acree. Gas Chromatography/Olfactory Analysis of Lychee (Litchi chinesis Sonn.). Journal of Agricultural and Food Chemistry. 1998, 46 (6): 2282–2286. doi:10.1021/jf9801318.
- ^ Carrero Gálvez, Miguel. Analysis of polyphenolic compounds of different vinegar samples. Zeitschrift für Lebensmittel-Untersuchung und -Forschung. 1994, 199: 29–31. S2CID 91784893. doi:10.1007/BF01192948..
- ^ Viriot, Carole; Augustin Scalbert; Catherine Lapierre; Michel Moutounet. Ellagitannins and lignins in aging of spirits in oak barrels. Journal of Agricultural and Food Chemistry. 1993, 41 (11): 1872–1879. doi:10.1021/jf00035a013.
- ^ Semmelroch, P.; Laskawy, G.; Blank, I.; Grosch, W. Determination of potent odourants in roasted coffee by stable isotope dilution assays. Flavour and Fragrance Journal. 1995, 10: 1–7. doi:10.1002/ffj.2730100102.
- ^ Kermasha, S.; M. Goetghebeur; J. Dumont. Determination of Phenolic Compound Profiles in Maple Products by High-Performance Liquid Chromatography. Journal of Agricultural and Food Chemistry. 1995, 43 (3): 708–716. doi:10.1021/jf00051a028.
- ^ Buttery, Ron G.; Louisa C. Ling. Volatile Flavor Components of Corn Tortillas and Related Products. Journal of Agricultural and Food Chemistry. 1995, 43 (7): 1878–1882. doi:10.1021/jf00055a023.
- ^ Guth, Helmut; Werner Grosch. Odorants of extrusion products of oat meal: Changes during storage. Zeitschrift für Lebensmittel-Untersuchung und -Forschung A. 1995, 196 (1): 22–28. S2CID 82716730. doi:10.1007/BF01192979.
- ^ 26.0 26.1 Walton 2003.
- ^ Arana, Francisca E. ACTION OF a β-GLUCOSIDASE IX THE CURING OF VANILLA. Journal of Food Science. 1943, 8 (4): 343–351. doi:10.1111/j.1365-2621.1943.tb18011.x.
- ^ Odoux, Eric. Changes in vanillin and glucovanillin concentrations during the various stages of the process traditionally used for curing Vanilla fragrans beans in Reunion. Fruits. 2000, 55 (2): 119–125.
- ^ Voisine, Richard; Carmichael, Lucie; Chalier, Pascale; Cormier, Francois; Morin, Andre. Determination of Glucovanillin and Vanillin in Cured Vanilla Pods. Journal of Agricultural and Food Chemistry. 1995, 43 (10): 2658–2661. Bibcode:1995JAFC...43.2658V. doi:10.1021/jf00058a019.
- ^ Dixon, R. A. Vanillin Biosynthesis – Not as simple as it seems? (PDF). Handbook of Vanilla Science and Technology. 2014: 292.
- ^ 31.0 31.1 31.2 Gallage, N. J.; Hansen, E. H.; Kannangara, R.; Olsen, E. C.; Motawia, M. S.; Jørgensen, K.; Holme, I.; Hebelstrup, K.; Grisoni, M.; Møller, L. B. Vanillin formation from ferulic acid in Vanilla planifolia is catalysed by a single enzyme. Nature Communications. 2014, 5: 4037. Bibcode:2014NatCo...5.4037G. PMC 4083428 . PMID 24941968. doi:10.1038/ncomms5037.
注释
编辑- ^ 根据 Esposito 1997,盲测小组无法区分木质素和愈创木酚来源合成的香兰素,但可以分辨二者的气味。若向愈创木酚来源的香兰素中掺入香草乙酮,则无法区分二者的香气差异。
- ^ 根据Hocking 1997,合成香兰素于 1874 年开始商业销售。同年,现代香精香料制造商德之馨公司的前身之一哈曼•雷默公司发表悌曼和哈曼的原始合成方法。不过,据Esposito 1997称,合成香兰素最早出现于 1894年,当时罗纳-普朗克公司开始涉足香兰素业务。
参考文献
编辑参考书籍
编辑- 邢其毅等. 《基础有机化学》第四版(上册). 北京大学出版社. 2017a.
- 邢其毅等. 《基础有机化学》第四版(下册). 北京大学出版社. 2017b.
- 亚历克斯. 基礎報告. HEP. 2005.
