吉非替尼
吉非替尼(Gefitinib),商品名为 艾瑞莎(Iressa),由阿斯利康制药和Teva发售。被用为治疗乳癌、肺癌和其它癌症。
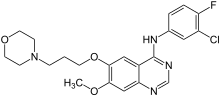 | |
 | |
| 临床资料 | |
|---|---|
| 商品名 | Iressa |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a607002 |
| 怀孕分级 | |
| 给药途径 | Oral |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 |
|
| 药物动力学数据 | |
| 生物利用度 | 59% (oral) |
| 血浆蛋白结合率 | 90% |
| 药物代谢 | Hepatic (mainly CYP3A4) |
| 生物半衰期 | 6–49 hours |
| 排泄途径 | Faecal |
| 识别信息 | |
| |
| CAS号 | 184475-35-2 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.171.043 |
| 化学信息 | |
| 化学式 | C22H24ClFN4O3 |
| 摩尔质量 | 446.91 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
吉非替尼与厄洛替尼同是表皮生长因子受体抑制剂,通过抑制靶细胞的表皮生长因子受体来中断信号传导,从而抑制癌细胞。
它在世界卫生组织的基本药物名单上,并可被作为仿制药出售。[1]
药理作用
编辑Gefitinib 是第一个选择性作用于表皮生长因子受体的酪胺酸激酶结构域的药物。表皮生长因子受体是一个家族,包括有Her1(erb-B1)、 Her2(erb-B2) 跟 Her 3(erb-B3)。在人类某几种特定的癌症中,表皮生长因子受体会过度表达,比如乳癌跟肺癌。表皮生长因子受体过度的活化,就会导致抗细胞凋亡Ras细胞信号传送被不正常地激活,致使细胞分裂不受控制。对 Gefitinib-敏感型的非小细胞肺癌(non-small cell lung cancers)的研究发现表皮生长因子受体的酪胺酸激酶的突变是启动抗细胞凋亡通路(anti-apoptotic pathway)的主因。携带这个突变的细胞对gefitinib 和 erlotinib 敏感。
Gefitinib 会共价结合到酶的腺苷三磷酸(ATP)结合位点来抑制了表皮生长因子受体的酪胺酸激酶,导致抗凋亡的Ras信号哦级联反应得到抑制,从而抑制癌细胞的增殖。
医药应用
编辑美国食品药物管理局在2003年核准 Gefitinib 用于非小细胞肺癌。现在它已经在多个国家发售。
但在2005年六月,美国食物及药物管理局撤回批准用于新病人,因为缺乏使用这种药物可以延长寿命的证据。
Iressa于2002年7月在日本获得批准并上市,成为第一个进口该药物的国家。
FDA于2003年5月批准吉非替尼用于非小细胞肺癌(NSCLC)。 它被批准作为单一疗法,用于治疗铂类和多西紫杉醇化疗失败后的局部晚期或转移性 NSCLC 患者。
2005 年 6 月,FDA 撤回了用于新患者的批准,因为缺乏延长寿命的证据。
在欧盟,吉非替尼自2009年起被用于晚期NSCLC的所有治疗领域,用于携带EGFR突变的患者。吉非替尼被证明是一线治疗药物,与铂类双药方案相比,在携带此类突变的患者中,该标签被证明可显著改善无进展生存期。IPASS是四项III期试验中第一个证实吉非替尼在该患者群体中具有优越性的研究。
在吉非替尼上市的大多数其他国家,吉非替尼被批准用于既往接受过至少一种化疗方案的晚期非小细胞肺癌患者。然而,根据最新的科学证据,目前正在申请将其标签扩大为携带EGFR突变的患者的一线治疗。 截至2012年8月,新西兰已批准吉非替尼作为初治局部晚期或转移性、不可切除NSCLC的EGFR突变患者的一线治疗。这是由公共资助的,最初为期四个月,如果没有进展,则续签。
2015年7月,FDA批准吉非替尼作为NSCLC的一线治疗药物。
参考资料
编辑- ^ Research, Center for Drug Evaluation and. First Generic Drug Approvals. FDA. 2022-10-17 [2024-04-10]. (原始内容存档于2021-01-26) (英语).