铃兰氨酸
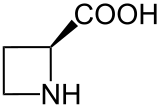
铃兰氨酸,学名L-(-)-环丁胺-2-羧酸(英語:L-(-)-Azetidine-2-carboxylic acid),缩写为Aze或Azc,是一种非蛋白质氨基酸,为脯氨酸的同系物。在结构上,铃兰氨酸为一个含氮四元环吖丁啶连接一个羧基取代基得到,其与脯氨酸的区别在于前者为四元环,后者为五元环[2]。铃兰氨酸具有作为脯氨酸类似物的能力,可以代替脯氨酸整合到蛋白质中。
| 铃兰氨酸[1] | |
|---|---|
| |
| IUPAC名 Azetidine-2-carboxylic acid | |
| 别名 | L-(-)-环丁胺-2-羧酸 氮杂环丁烷-2-羧酸 吖丁啶-2-羧酸 |
| 识别 | |
| CAS号 | 2133-34-8 |
| PubChem | 16486(L-) |
| ChemSpider | 15628 |
| SMILES |
|
| InChI |
|
| InChIKey | IADUEWIQBXOCDZ-VKHMYHEABQ |
| ChEBI | 6198 |
| KEGG | C08267 |
| IUPHAR配体 | 4686 |
| 性质 | |
| 化学式 | C4H7NO2 |
| 摩尔质量 | 101.104 g/mol g·mol⁻¹ |
| 外观 | 晶体颗粒 |
| 密度 | 1.275 g/cm3 |
| 熔点 | 215 °C(488 K) |
| 沸点 | 242 °C(515 K) |
| 溶解性(水) | 5.0 g/100 ml |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
合成
编辑铃兰氨酸可由γ-羟基丁酸通过α-溴化反应少量获得的。溴化反应得到的γ-氨基-α-溴丁酸中间体中除去溴化氢,再用氢氧化钡溶液处理进行环合即可得到。光学活性的铃兰氨酸是通过将α,γ-二氨基丁酸二盐酸盐与亚硝酸和盐酸混合物反应生成γ-氨基-α-氯丁酸,然后消去氯化氢,再用氢氧化钡处理进行环化而获得[3]。
分布
编辑铃兰氨酸于1955年发现,其存在于一些特定植物的根茎和新鲜叶片中,已知其存在于铃兰和黄精属等天门冬科植物中。
在一些豆科植物中也发现了铃兰氨酸。在一些食用、园艺和糖用甜菜中也发现了少量铃兰氨酸[4]。
毒性
编辑研究表明,当铃兰氨酸被错误地代替脯氨酸整合到蛋白质中时,铃兰氨酸会阻碍竞争植物的生长并毒害捕食者。其他研究表明,铃兰氨酸会导致鸭、仓鼠、老鼠和兔子等各种动物出现各种毒性和致畸性疾病[2]。
铃兰氨酸错误整合到人体蛋白质中会改变胶原蛋白、角蛋白、血红蛋白和蛋白质折叠[5]。然而,由于缺乏详细的毒理学数据,以及需要更多关于铃兰氨酸对特定蛋白质的破坏性影响的直接证据,因此目前无法确定其对人体的毒性[2]。对人类脯氨酰-转运核糖核酸合成酶和丙氨酰-tRNA合成酶的分子研究表明,铃兰氨酸以脯氨酸的形式整合到蛋白质中,并在体内产生毒性[6]。由于其对丙氨酸和脯氨酸的双重模仿作用,即使铃兰氨酸似乎适合两种tRNA合成酶的活性位点,它也会被丙氨酰-tRNA合成酶的转移后编译系统拒绝[6]。
参考文献
编辑- ^ 默克索引, 12th Edition, 6089.
- ^ 2.0 2.1 2.2 Rubenstein E.; T. McLaughlin; R.C. Winant; A. Sanchez; M. Eckart; K.M. Krasinska; A. Chien. Azetidine-2-carboxylic Acid in the Food Chain. Phytochemistry. 2008, 70 (1): 1–5. PMID 19101705. doi:10.1016/j.phytochem.2008.11.007.
- ^ Fowden, L. Azetidine-2-carboxylic Acid: a New Cyclic Imino Acid Occurring in Plants. Biochemical Journal. 1956, 64 (2): 323–331. PMC 1199734 . PMID 13363844. doi:10.1042/bj0640323.
- ^ Seigler, David S. Plant secondary metabolism. Kluwer Academic. 1998: 222. ISBN 0-412-01981-7.
- ^ Rubenstein E.; H. Zhou; K.M. Krasinska; A. Chien; C.H. Becker. Azetidine-2-carboxylic Acid in Garden Beets. Phytochemistry. 2006, 67 (9): 898–903. PMID 16516254. doi:10.1016/j.phytochem.2006.01.028.
- ^ 6.0 6.1 Song, Y; Zhou, H; Vo, MN; Shi, Y; Nawaz, MH; Vargas-Rodriguez, O; Diedrich, JK; Yates, JR; Kishi, S; Musier-Forsyth, K; Schimmel, P. Double mimicry evades tRNA synthetase editing by toxic vegetable-sourced non-proteinogenic amino acid.. Nature Communications. 22 December 2017, 8 (1): 2281. Bibcode:2017NatCo...8.2281S. PMC 5741666 . PMID 29273753. doi:10.1038/s41467-017-02201-z.