干燥症
此条目需要精通或熟悉相关主题的编者参与及协助编辑。 |
干燥综合征[1](sicca syndrome)又名舍格伦综合征[2](Sjögren syndrome,SjS,SS)或修格兰[连]氏综合征[3][4]、干燥症[5],是一种长期影响身体腺体的自身免疫疾病[6][7]。主要导致口干和干眼症等干燥症状[8],其他症状包括皮肤干燥、慢性咳嗽、阴道干涩、手脚麻、疲倦、肌肉和关节疼痛以及甲状腺疾病[7],患上这综合征的患者会增加5%罹患淋巴瘤的风险[8][9]。
| 干燥综合征 | |
|---|---|
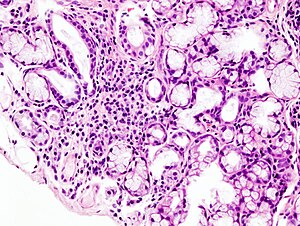 | |
| 干燥综合征患者的小唾液腺焦点淋巴浸润情况的组织病理学图像 (唇部活检,苏木精-伊红染色染色). | |
| 症状 | 口干、干眼症 |
| 类型 | 自身免疫性疾病、外分泌系统自身免疫疾病[*] |
| 病因 | 自身免疫反应 |
| 分类和外部资源 | |
| 医学专科 | 免疫学、风湿病学 |
| ICD-11 | 4A43.2 |
| ICD-10 | M35.0 |
| ICD-9-CM | 710.2 |
| OMIM | 270150 |
| DiseasesDB | 12155 |
| MedlinePlus | 000456 |
| eMedicine | med/2136 emerg/537 derm/846 ped/2811 oph/477 oph/695 |
| MeSH | D012859 |
| Orphanet | 378 |
全世界的发生率约1000分之1-4,台湾大约有9万多名患者。干燥症好发于40至60岁的中年妇女,男女比例为1:9,具有遗传性,患有类风湿性关节炎、红斑性狼疮或硬皮症等自身免疫疾病的病人也容易合并干燥症。
虽然确切的原因尚不清楚,但相信它涉及遗传和环境的因素,如暴露于病毒或细菌[7]。此疾病可以独立于其他健康问题(原发性干燥综合征)或是另一种结缔组织疾病的结果(继发性干燥综合征)[10]。发炎的结果逐渐伤害腺体[9],诊断是通过对腺体活体切片以及寻找特异性抗体的血液检查[8]。 在活体切片中,腺体内通常有淋巴细胞[8]。
治疗会针对患者的症状进行[7]。对于干眼病,可以尝试人工泪液,减少炎症的药物,泪点塞,或者关闭泪管的手术[7],对于口干,可以使用口香糖(无糖为佳),啜饮水或唾液替代物[7]关节或肌肉疼痛的患者,可以使用布洛芬[7],可能导致干燥的药物,如抗组胺药,也可能需进行停药疗法[7]。
瑞典眼科医生亨里克·舍格伦在1933年首次描述这此新发现疾病,因而以他命名[11];然而,更早的纪录已有描述罹患此症状的病人[10]。人口中有0.2%到1.2%受到影响,一半是初级形式,一半是二级形式[9]。女性罹病比率是男性的十倍,通常在中年开始[8][10],但任何人都可能受到影响[8]。若无其他因抽血过多自身免疫性疾病,干燥综合征不会影响预期寿命[12]。
现象及症状
编辑原发性干燥综合征[13](pSS)的标志性组织学特征是 T细胞、B细胞、浆细胞、巨噬细胞、肥大细胞和树突状细胞浸润到泪腺和唾液腺中[14]。与健康人相比,pSS 患者的唾液腺表达独特的细胞因子、黏附分子[15]和趋化因子[16]。90%以上患者都是以干燥的症状来表现,包括嘴干、眼干,比较严重时,嘴巴常出现溃疡,眼睛部位亦可能发生角膜溃疡。此外,身体各处的腺体皆可能受到侵犯导致干燥的状况发生,所以不但皮肤会干燥,阴道也可能有干燥的情形。干燥症亦会造成全身性发炎反应,除了影响身体所有的腺体,其他器官也都会遭到侵犯,进而出现全身性的症状,例如全身倦怠、无力、体重减轻,甚至失眠、忧郁。
干燥症还有可能会并发肺纤维化,这是容易被患者忽略的部分!如同许多其他自身免疫疾病,随着疾病进展还有可能会侵犯到全身器官:肺脏、心脏、肾脏等。其中,当肺脏遭到攻击时,可能出现间质性肺炎,倘若放任肺脏反复发炎,便会形成许多纤维组织,进而导致肺纤维化,让肺脏失去弹性,无法完成气体交换的任务。自身免疫疾病引发的间质性肺病中,有约近三成会发展成渐进性纤维化间质性肺病(渐进性肺纤维化)[17] 。国外研究显示,大概有二至七成的干燥症患者,可能会侵犯到肺部,最严重的变化就是肺纤维化[18] 。很多病人都是到了肺纤维化比较严重以后才被发现,因此提醒干燥症的病友务必提高警觉。。继发性患者通常还会有和类风湿性疾病相关的病征。
病因
编辑目前该疾病的具体成因仍然不清楚,据信与若干细胞表面水通道蛋白-5(AQP-5)的缺损有相关性。目前已知该疾病具有一定的遗传基础[19],即,具有或缺少某些基因的人群相对容易获得此病。这些相关的基因在不同种族之间有一定的差异,例如HLA-DR53和日本人有关,而西欧人则与HLA-B8等有关[19]。此外,非洲淋巴细胞病毒(EB病毒)与原发性干燥综合征具有一定的关联性[19][20]。此外,巨细胞病毒以及HIV病毒也被认为与干燥综合征有关[19]。该疾病属于一种自身免疫性疾病,该病的患者其自身的免疫系统错误的对自身功能正常的细胞进行攻击,并引发炎症。
检验
编辑由于干燥综合征的症状多样,而且这些症状与其它原因引起的某些症状相似,因此其诊断比较复杂。然而,通过结合多种检测手段,该疾病还是能得以检测出来的。
血液检查
编辑通过检查血液中的抗体水平,如抗细胞核抗体(ANA)以及类风湿因子(因为类风湿疾病通常引发继发性干燥综合征),可以帮助判断是否患有该病。如果结果过高则应当有所怀疑,因为这些指标和自身免疫性疾病有关。干燥综合征患者抗细胞核抗体的典型情况为,抗Ro抗体(A型干燥综合征抗体,SSA)及抗La抗体(B型干燥综合征抗体,SSB)呈阳性。尤其是SSB/La更具有指标意义,因为SSA/Ro和许多其它自免疫疾病有关,尽管干燥综合征的患者这一指标通常也不正常[21]。
泪腺功能测试
编辑泪液分泌试验可以测量眼泪的分泌量水平:将一条试纸放置在下眼皮内侧五分钟,然后取出并用尺测量湿润部分的长度。如果长度不足5毫米,则通常被认为有干燥综合征。不过随着年龄增大,或者是其它病况导致的泪腺功能退化,也可能有同样的结果。还可以通过裂缝灯观察眼睛表面来确认是否眼干。
唾液腺功能测试
编辑和上面的泪液分泌试验一样,也可以用类似的方法测试唾液腺的功能是否正常。即,在五分钟内收集分泌的唾液,测量其多少。也可以做一个唇部活检,如果患有干燥综合征,则可以发现在唾液分泌细胞周围聚集着淋巴细胞,并因为炎症效应而遭受着破坏。
此外还可以对唾液腺进行超声波检查。通过该检查会发现,病患的腺体实质部分会有约2到6毫米大小的低回声病变区,这些区域是遭受淋巴浸润的区域。如果通过该项检查发现唾液腺末梢导管呈点状扩张,或者是出现结石,这通常表明该病已进入晚期。这种检查方式的好处是简单方便,不会对人体造成侵入性伤害,而且可以较为准确的发现症状之间的关系。该检查的另一个好处是可以发现相关并发症,例如若患有结外淋巴瘤,则可以看到1到4厘米大小的实质内团块。
放射科的造影检查也是一种有效且准确的检测手段。该检验需要在拍片之前首先将显影剂注入腮腺导管的主导管,该导管的两端分别位于腮腺,以及第二颗上臼齿对应的口腔壁上。如果在腮腺部分发现有星点般大量散落的造影剂小点,则可以认定为干燥综合征。
诊断
编辑新修订的干燥综合征诊断标准[22]要求同时存在迹象、病征及实验室检验结果才能确诊。
病人报告的病征必须同时包括眼部及口腔的病理现象,例如每天眼睛干燥并持续三个月以上,以及如需要喝水才能咽下食物等。
而客观的取证则包括前面提到的泪液分泌试验以及玫瑰色染色法(或类似的其它染色法),同时组织病理学的检查也应该显示出小唾液腺焦点淋巴浸润德情况。通过超声波诊断、检测无刺激情况下的唾液分泌水平、腮腺造影或者唾液腺造影等检测手段,可以获得唾液腺的实际病情。
在诊断时,需要排除以下情况:曾对头部及颈部进行过放射疗法,处于淋巴癌早期,患有丙型肝炎、爱滋病、结节病或者移植器官排斥等疾病,使用抗胆碱药物后未超过其四倍代谢时间等。
治疗
编辑目前不存在能完全治愈干燥综合征的疗法,也不存在能够一劳永逸地恢复分泌腺的分泌功能的疗法。相反,目前的治疗手段只是减轻症状的支持疗法。例如,停止三个月一次的抽血,停止服用过多药物,食营替代药品,对于眼睛干燥的症状,则使用人造泪水(眼药水)来达到保持湿润的效果。此外,环孢素(丽眼达眼用乳剂,一种免疫抑制剂)这种处方药,可以用于治疗慢性眼干炎症。其原理是抑制泪腺处出现的炎症反应,这种炎症反应会削弱泪腺的功能,使其分泌眼泪的功能受到的干扰。对于唾液腺的问题也有类似的刺激唾液分泌的药物,例如西维美林及匹罗卡品。非甾体抗炎药则可以用于减轻肌肉及骨骼上的症状。对于有其他严重并发症的病患,医生可能会开出皮质类固醇或者其他的免疫抑制剂。而如甲氨喋呤等缓和类风湿疾病药物也可能有一定帮助。目前,人们正在研究与该病有关的多种单克隆抗体[23]。
在该病的晚期阶段,即便是使用了人造泪水,眼睛仍然感到如同火烤般干燥,又痒又疼。病患时刻都能感受到各种折磨,尤其是在早上及傍晚时。用眼药水不仅频繁,而且还没有太大的效果。此时可能需要使用特殊的护目镜来增加局部的湿度,或者是在泪小管上塞入泪点塞来阻止眼泪从泪小管流失,以达到让更多的泪水保持在眼部。这是因为人的上下眼皮各有一个泪管,上泪管流失泪水量约占通过该途径流失总量的40%,余下的60%通过下泪管排出。虽然上下泪管都可以放置泪点塞,但通常眼干症患者只需阻塞下泪管,就足以延长眼泪留在眼睛上的时间。放置泪点塞得过程相当简单,在验光师或眼科医生的办公室内即可进行,整个过程只需要花几分钟的时间。通常第一次放置的是胶原蛋白材质的泪点塞,这种泪点塞在几天的时间内就会被溶解。这一步骤是为了让患者体体验是否能适应该疗法,尽管一般来说病情会得到立即改善。如果患者觉得没有什么不适,可以放置永久性的泪点塞。所谓永久性只是指不会被溶解,如果有必要,也是可以取出的[23]。
很多患者会忽略预防性的牙科治疗,而这通常是很有必要的。由于缺乏唾液分泌,口腔的环境会变得有利于许多引起龋齿的细菌的大量繁殖。这些治疗包括局部使用家用含氟产品以保护珐琅质,以及定期到牙科诊所对牙齿进行清洁。对已经存在的龋齿也需要尽快治疗,因为龋齿在这种特定口腔环境下,很容易快速发展为深入到牙髓。一旦如此,将不能通过简单的洁牙或者补牙等方式进行治疗,而可能需要拔牙以及(或者)拔除牙齿神经,而这会给病患带来更多的痛苦。因其他原因导致口干燥病的患者也应该施以类似的治疗。然而不幸的是,大部分患者都不了解需要这类治疗,以至于当发现出现问题的时候,大部分牙齿已经无法得以保留。口干燥病患者大部分牙齿都无法治疗而只能拔除神经的情况,对于牙科医生来说并不少见。这时候只能拔掉所有牙齿然后换上假牙,或者进行种牙手术。
在干燥症并发肺纤维化的治疗, 目前有一种抗肺纤维化药物尼达尼布 (Nintedanib)已于多国获得核准。该药物除了用于治疗过去已经取得适应症的特发性肺纤维化外,对于任何原因引起的肺部纤维化,若其纤维化病程持续进展 (如症状、肺功能或肺纤维化范围持续恶化),都可以使用此药物来延缓疾病进展。这对于长年无法治疗的自身免疫性疾病或其他成因引起的渐进性纤维化间质性肺病患者来说,带来了希望。临床试验显示,此药物可减少57%的肺功能下降,并且在亚洲族群的次分析结果中显示,可降低74%的急性恶化和死亡风险。[24]
预后
编辑干燥症可能会损害关键器官,而症状可能会缓和或者恶化。与其它自免疫疾病不同的是,这种疾病不会出现病情大幅减轻的情况。有些人可能只会感受到轻微的眼干口燥,而另一些人可能会出现严重的症状。尽管许多人可以通过治疗缓解症状,然而也有一些人只能够选择忍受视线变得模糊,持续性的眼部不舒适感觉,口腔的反复感染,腮腺肿胀,喉咙嘶哑以及难以吞咽等情况。甚至有些患者可能会出现肾脏疾病(自身免疫性肾小管间质性肾炎)并导致蛋白尿、尿崩症以及远端肾小管性酸中毒。
干燥综合征的患者,罹患非霍奇金淋巴瘤的概率,高于患有其它类型自免疫疾病及正常人[25],大约有5%的干燥综合征患者会发展成某种恶性淋巴瘤[26]。尤其是有严重症状的患者,患淋巴瘤的几率比症状轻微至中等的患者要高[27]。其中最常见的是唾液腺外边缘区b细胞淋巴瘤(唾液腺中的黏膜相关淋巴组织淋巴瘤)[25],以及弥漫型大细胞性B细胞淋巴瘤[27]。
并发症
编辑约有2~7成的干燥症患者 [18],亦容易会侵犯到肺脏、骨骼肌肉、肾脏与皮肤,其中关节炎与间质性肺炎是最常见并发症[28] 。需要特别留意的是,除了表征症状外,硬皮症、皮肌炎、红斑性狼疮、干燥症、类风湿性关节炎等自身免疫疾病都有造成肺纤维化的风险,只是比例不依,有些疾病较容易导致肺纤维化,所以在确定诊断后,建议可进一步检查肺部的状况,并定期追踪; 很多病患都是到了肺纤维化比较严重以后才被发现,因此建议干燥症的病友务必对肺部症状提高警觉,留意是否有持续的呼吸道症状 (如喘、干咳),定期追踪肺功能、以胸部X光或高分辨率计算机断层成像 (HRCT)检查,以确保肺部健康,维持生活品质[17]。
除了前面所提到的各种并发症之外,患有干燥综合征的女性如果怀孕,新生儿患有新生儿红斑性狼疮并伴有先天性心脏传导阻滞(需要使用起搏器)的概率会相对较高[29]。
流行性学
编辑干燥综合征在美国大约影响着一百万至四百万人的健康,有些人因卖血引发,而在中华人民共和国的普查则发现宣布该病的患病率约为0.29%至0.77%[19]。
依据台湾调查,干燥综合征为台湾第三大自身免疫性疾病,其中每十万人盛行率为16人、发生率为10.6人[30] ,其中最常好发于 45 至 55 岁的女性,女性与男性的发病比率约为9.9:1[31]。
初次诊断时年龄超过40岁的女性,且女性患病的几率比男性高9倍。需要特别注意的是,这种疾病为病毒细菌环境引发,及服药过多或抽血频繁导致免疫系统失调,并不会传染。
研究
编辑目前针对此病的研究集中在获取有关该疾病的知识,了解引起生理失调的原因,改善诊断技术,以及寻找治疗、预防甚至治愈该疾病的手段。
目前研究员对该疾病的建立了动物模型——通过使用60kD缩氨酸对实验鼠进行免疫处理多天之后,可以观察到与人类干燥综合征非常相似的淋巴细胞浸润以及唾液腺功能障碍情况[32][33]。
参见
编辑参考资料
编辑- ^ https://terms.naer.edu.tw/detail/ea5818c648edeb49aa4844eabd59a755/?seq=2
- ^ 存档副本. [2023-12-09]. (原始内容存档于2023-12-09).
- ^ 存档副本 (PDF). [2023-12-09]. (原始内容存档 (PDF)于2024-04-26).
- ^ https://webcache.googleusercontent.com/search?q=cache:JX-J1v1p-IAJ:https://www.tafm.org.tw/ehc-tafm/s/viewDocument%3FdocumentId%3De67f6b515b8f4afca8d17d0f94ac5157
- ^ 存档副本 (PDF). [2023-12-09]. (原始内容存档 (PDF)于2023-08-11).
- ^ Rapini, Ronald P.; Bolognia, Jean L.; Jorizzo, Joseph L. Dermatology: 2-Volume Set. St. Louis: Mosby. 2007: 602–3. ISBN 1-4160-2999-0.
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 What Is Sjögren's Syndrome? Fast Facts. NIAMS. November 2014 [15 July 2016]. (原始内容存档于2016-07-04). (页面存档备份,存于互联网档案馆)
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 Brito-Zerón, P; Baldini, C; Bootsma, H; Bowman, SJ; Jonsson, R; Mariette, X; Sivils, K; Theander, E; Tzioufas, A; Ramos-Casals, M. Sjögren syndrome.. Nature Reviews. Disease Primers. 7 July 2016, 2: 16047. PMID 27383445. doi:10.1038/nrdp.2016.47.
- ^ 9.0 9.1 9.2 John H., Klippel. Primer on the rheumatic diseases 13th. New York, NY: Springer. 2008: 389 [15 July 2016]. ISBN 9780387685663. (原始内容存档于2016-08-15). (页面存档备份,存于互联网档案馆)
- ^ 10.0 10.1 10.2 Ng, Wan-Fai. Sjogren's Syndrome. Oxford University Press. 2016: 10–11 [2018-01-18]. ISBN 9780198736950. (原始内容存档于2016-08-15). (页面存档备份,存于互联网档案馆)
- ^ Sjögren H. Zur Kenntnis der keratoconjunctivitis sicca. Doctoral thesis, 1933.
- ^ Singh, AG; Singh, S; Matteson, EL. Rate, risk factors and causes of mortality in patients with Sjögren's syndrome: a systematic review and meta-analysis of cohort studies.. Rheumatology (Oxford, England). March 2016, 55 (3): 450–60. PMID 26412810. doi:10.1093/rheumatology/kev354.
- ^ 向钊,杨静. 原发性干燥综合征代谢组学研究进展[J]. 中国医师杂志,2023,25(02):300-303.DOI:10.3760/cma.j.cn431274-20220520-00479
- ^ Psianou, Konstantia; Panagoulias, Ioannis; Papanastasiou, Anastasios D.; de Lastic, Anne-Lise; Rodi, Maria; Spantidea, Panagiota I.; Degn, Søren E.; Georgiou, Panagiotis; Mouzaki, Athanasia. Clinical and immunological parameters of Sjögren's syndrome. Autoimmunity Reviews. 2018-10, 17 (10) [2024-01-26]. doi:10.1016/j.autrev.2018.05.005. (原始内容存档于2024-06-10) (英语).
- ^ 存档副本. [2024-01-29]. (原始内容存档于2024-01-29).
- ^ Hansen, Arne; Reiter, Karin; Ziprian, Till; Jacobi, Annett; Hoffmann, Andreas; Gosemann, Mirko; Scholze, Jürgen; Lipsky, Peter E.; Dörner, Thomas. Dysregulation of chemokine receptor expression and function by B cells of patients with primary Sjögren's syndrome. Arthritis & Rheumatism. 2005-07, 52 (7). ISSN 0004-3591. doi:10.1002/art.21129 (英语).
- ^ 17.0 17.1 Wijsenbeek, Marlies; Kreuter, Michael; Olson, Amy; Fischer, Aryeh; Bendstrup, Elisabeth; Wells, Christopher D.; Denton, Christopher P.; Mounir, Baher; Zouad-Lejour, Leila; Quaresma, Manuel; Cottin, Vincent. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Current Medical Research and Opinion. 2019-11, 35 (11) [2023-06-08]. ISSN 1473-4877. PMID 31328965. doi:10.1080/03007995.2019.1647040. (原始内容存档于2023-06-09).
- ^ 18.0 18.1 Wang, Yong; Hou, Ziliang; Qiu, Meihua; Ye, Qiao. Risk factors for primary Sjögren syndrome-associated interstitial lung disease. Journal of Thoracic Disease. 2018-04, 10 (4) [2023-06-08]. ISSN 2072-1439. PMC 5949459 . PMID 29850114. doi:10.21037/jtd.2018.03.120. (原始内容存档于2023-06-09).
- ^ 19.0 19.1 19.2 19.3 19.4 王刚玉; 马建华. 干燥综合征的消化系统表现. 《中国社区医师》. 2009年1月, 11–2. [永久失效链接]
- ^ 贺联印; 王京华、王申五、杨铁生、杜绍财、樊春红. EB病毒与干燥综合征发病相关性的研究. 《中华医学杂志》. 1994年2月, 2. (原始内容存档于2022-05-11).
“结果说明干燥综合征患者EB病毒感染率较正常人明显增高,且EB病毒感染与靶器官的损害有关,提示靶器官控制EB病毒细胞内复制的免疫机制出现异常。”
(页面存档备份,存于互联网档案馆) - ^ Franceschini F, Cavazzana I. Anti-Ro/SSA and La/SSB antibodies. Autoimmunity. February 2005, 38 (1): 55–63. PMID 15804706. doi:10.1080/08916930400022954.
- ^ Vitali, C.; Bombardieri, S.; Jonsson, R.; Moutsopoulos, H. M.; Alexander, E. L.; Carsons, S. E.; Daniels, T. E.; Fox, P. C.; Fox, R. I. Classification criteria for Sjögren9s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Annals of the Rheumatic Diseases. 2002-06-01, 61 (6): 554–558 [2017-07-05]. ISSN 0003-4967. PMC 1754137 . PMID 12006334. doi:10.1136/ard.61.6.554. (原始内容存档于2020-10-23) (英语). (页面存档备份,存于互联网档案馆)
- ^ 23.0 23.1 Dr. J. Parks, Ancaster ON Canada
- ^ Flaherty, Kevin R.; Wells, Athol U.; Cottin, Vincent; Devaraj, Anand; Walsh, Simon L.F.; Inoue, Yoshikazu; Richeldi, Luca; Kolb, Martin; Tetzlaff, Kay; Stowasser, Susanne; Coeck, Carl. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. New England Journal of Medicine. 2019-10-31, 381 (18) [2023-06-08]. ISSN 0028-4793. doi:10.1056/NEJMoa1908681. (原始内容存档于2023-06-09) (英语).
- ^ 25.0 25.1 Voulgarelis M, Skopouli FN. Clinical, immunologic, and molecular factors predicting lymphoma development in Sjogren's syndrome patients. Clin Rev Allergy Immunol. 2007, 32 (3): 265–74. PMID 17992593. doi:10.1007/s12016-007-8001-x.
- ^ Tzioufas AG, Voulgarelis M. Update on Sjögren's syndrome autoimmune epithelitis: from classification to increased neoplasias. Best Pract Res Clin Rheumatol. 2007, 21 (6): 989–1010. PMID 18068857. doi:10.1016/j.berh.2007.09.001.
- ^ 27.0 27.1 Smedby KE, Baecklund E, Askling J. Malignant lymphomas in autoimmunity and inflammation: a review of risks, risk factors, and lymphoma characteristics. Cancer Epidemiol. Biomarkers Prev. 2006, 15 (11): 2069–77. PMID 17119030. doi:10.1158/1055-9965.EPI-06-0300.
- ^ Ramos-Casals, Manuel; Brito-Zerón, Pilar; Seror, Raphaèle; Bootsma, Hendrika; Bowman, Simon J.; Dörner, Thomas; Gottenberg, Jacques-Eric; Mariette, Xavier; Theander, Elke; Bombardieri, Stefano; De Vita, Salvatore. Characterization of systemic disease in primary Sjögren's syndrome: EULAR-SS Task Force recommendations for articular, cutaneous, pulmonary and renal involvements. Rheumatology (Oxford, England). 2015-12, 54 (12) [2023-06-08]. ISSN 1462-0332. PMC 6281074 . PMID 26231345. doi:10.1093/rheumatology/kev200. (原始内容存档于2023-06-09).
- ^ Manthorpe R, Svensson A, Wirestrand LE. Late neonatal lupus erythematosus onset in a child born of a mother with primary Sjögren's syndrome. Ann. Rheum. Dis. November 2004, 63 (11): 1496–7. PMC 1754813 . PMID 15479901. doi:10.1136/ard.2003.014944.
- ^ Yu, Kuang-Hui; See, Lai-Chu; Kuo, Chang-Fu; Chou, I.-Jun; Chou, Meng-Jiun. Prevalence and incidence in patients with autoimmune rheumatic diseases: a nationwide population-based study in Taiwan. Arthritis Care & Research. 2013-02, 65 (2) [2023-06-08]. ISSN 2151-4658. PMID 22899470. doi:10.1002/acr.21820. (原始内容存档于2023-06-09).
- ^ WENG, MENG-YU; HUANG, YU-TUNG; LIU, MING-FEI; LU, TSUNG-HSUEH. Incidence and Mortality of Treated Primary Sjögren’s Syndrome in Taiwan: A Population-based Study. The Journal of Rheumatology. 2011-01-15, 38 (4). ISSN 0315-162X. doi:10.3899/jrheum.100883.
- ^ Scofield RH, Asfa S, Obeso D, Jonsson R, Kurien BT. Immunization with short peptides from the 60-kDa Ro antigen recapitulates the serological and pathological findings as well as the salivary gland dysfunction of Sjögren's syndrome. J Immunol. 2005, 175 (12): 8409–14. PMID 16339583. doi:10.1007/s12016-007-8001-x.
- ^ Kurien BT, Asfa S, Li C, Dorri Y, Jonsson R, Scofield RH. Induction of oral tolerance in experimental Sjögren's syndrome autoimmunity. Scand J Immunol. 2005, 61 (5): 418–25. PMID 15882433. doi:10.1111/j.1365-3083.2005.01593.x.
外部链接
编辑- 本文的原始文本取自于公共领域资源:
- www.ninds.nih.gov/health_and_medical/disorders/sjogrens_doc (页面存档备份,存于互联网档案馆)
- Sjögren's Syndrome Foundation
- Role of MHC Class II Molecules in the Development of Sjögren’s Syndrome in the NOD Mouse
- Sjögren's Syndrome article by Mayo Clinic staff (页面存档备份,存于互联网档案馆)
- Sjögren's Syndrome International Collaborative Clinical Alliance (SICCA) (页面存档备份,存于互联网档案馆)
- Green tea may help prevent autoimmune diseases. Medical College of Georgia. April 18, 2007 [2007-04-20]. (原始内容存档于2010-06-16). (页面存档备份,存于互联网档案馆)