溶菌酶
溶菌酶(英文名称:Lysozyme,又译溶解酶)是一个分子量为14.4kDa的抗菌酶,属于先天免疫系统的一员,它可经由催化细菌细胞壁肽聚糖中的N-乙酰胞壁酸和N-乙酰葡糖胺残基间的1,4-β-糖苷键水解,而破坏细菌的细胞壁。由于革兰氏阳性菌的肽聚糖层远厚于革兰氏阴性菌,且为其细胞壁主成分,此酶主要针对革兰氏阳性菌。
| 溶菌酶 | |
|---|---|

| |
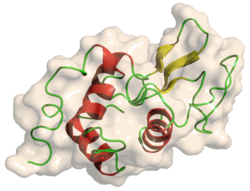
| 溶菌酶的单晶 | |
| 识别 | |
| 符号 | LYZ |
| Entrez | 4069 |
| HUGO | 6740 |
| OMIM | 153450 |
| RefSeq | NM_000239 |
| UniProt | P61626 |
| 其他数据 | |
| EC编号 | 3.2.1.17 |
| 基因座 | 12 [1] |
历史
编辑1909年,Laschtschenko发现蛋清中有杀菌物质。1922年,亚历山大·弗莱明在研究鼻腔粘液的抗菌作用时发现并命名了溶菌酶。[1]
1965年,大卫·菲利浦用X射线衍射技术研究溶菌酶晶体,解析出了2埃分辨率的晶体结构。[2][3]这是第二个使用X射线衍射技术得到的蛋白质结构,也是第一个解析出的酶结构。大卫·菲利浦根据次结构提出了溶菌酶催化的机理,该催化机理最近得到了修正。[4]
生理学功能
编辑溶菌酶是体内免疫系统的一部分,可杀灭革兰氏阳性菌。溶菌酶结合到细菌表面,减少负电荷并协助对细菌的吞噬作用。新生儿缺乏溶菌酶会导致肺支气管发育不良(bronchopulmonary dysplasia)。食用缺乏溶菌酶的配方奶粉会使婴儿腹泻的概率提高三倍。眼泪中缺乏溶菌酶会导致结膜炎。
某些癌细胞会分泌过量的溶菌酶,导致血液中溶菌酶含量过高,造成肾衰竭和低血钾。
催化机制
编辑溶菌酶进攻肽聚糖(细菌细胞壁的组分,特别在革兰氏阳性菌的细胞壁中含量丰富)水解连接N-乙酰胞壁酸和N-乙酰葡糖胺第四位碳原子的糖苷键。整个过程是,首先溶菌酶通过其两个结构域之间的“沟”结合到肽聚糖分子上;随后其底物在酶中形成过渡态的构象。根据Phillips机制,溶菌酶与葡聚六糖结合。然后溶菌酶将葡聚六糖上的第四个糖扭曲为半椅形构象。在这种扭曲状态(能量较高)中,糖苷键很容易就发生断裂。
位于溶菌酶蛋白序列35位的谷氨酸(Glu35)和52位的天冬氨酸(Asp52)的侧链被发现对于溶菌酶的活性非常关键。Glu35作为糖苷键的质子供体,剪切底物的C-O键;而Asp52作为亲核试剂参与生成糖基酶中间体。随后,糖基酶中间体与水分子发生反应,水解生成产物,而酶保持不变。
相关疾病
编辑应用
编辑溶菌酶被广泛用于实验室中对细菌所进行的细胞破碎。
由于溶菌酶易于结晶,常被用于各种晶体学相关的研究。
参见
编辑参考文献
编辑- ^ Fleming, Alexander; Wright, Almroth Edward. On a remarkable bacteriolytic element found in tissues and secretions. Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character. 1922-05-01, 93 (653) [2022-08-28]. doi:10.1098/rspb.1922.0023. (原始内容存档于2022-10-21).
- ^ Blake, C. C. F.; Koenig, D. F.; Mair, G. A.; North, A. C. T.; Phillips, D. C.; Sarma, V. R. Structure of Hen Egg-White Lysozyme: A Three-dimensional Fourier Synthesis at 2 Å Resolution. Nature. 1965-05, 206 (4986) [2022-08-28]. ISSN 1476-4687. doi:10.1038/206757a0. (原始内容存档于2022-11-21) (英语).
- ^ Johnson, Louise N.; Phillips, D. C. Structure of Some Crystalline Lysozyme-Inhibitor Complexes Determined by X-Ray Analysis At 6 Å Resolution. Nature. 1965-05, 206 (4986) [2022-08-28]. ISSN 1476-4687. doi:10.1038/206761a0. (原始内容存档于2022-08-28) (英语).
- ^ Vocadlo, David J.; Davies, Gideon J.; Laine, Roger; Withers, Stephen G. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate. Nature. 2001-08, 412 (6849) [2022-08-28]. ISSN 0028-0836. doi:10.1038/35090602. (原始内容存档于2022-10-08) (英语).
- ^ OMIM 105200