基因重组
遗传学中,基因重组(英语:genetic recombination/reshuffling)亦称遗传重组,是指DNA片段断裂并且转移位置的过程,会导致基因间或基因内新的连锁关系形成。对于真核生物,减数分裂过程中的基因重组能够形成一套新的遗传信息,并从亲本遗传给子代。多数基因重组是自然发生的,可以分为两种类型:(1)染色体间重组,通过位点在不同染色体上的等位基因的自由组合发生(减数分裂I中同源染色体的非姐妹染色单体上的基因自由组合);(2)染色体内重组,通过交换发生。[1]
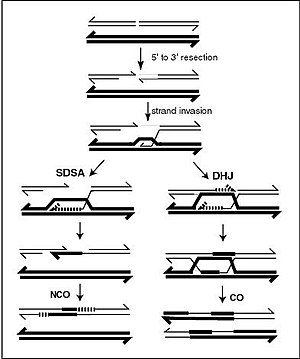
在真核生物减数分裂过程中,遗传重组时同源染色体会配对。随后可能会发生染色体间的遗传信息传递。信息传递可以不需要物理交换(遗传物质的一部分从一条染色体复制到另一条染色体,而来源的染色体并未改变,见图中SDSA路径),也可以通过DNA链断裂并重新连接,形成新的DNA分子(见图中DHJ路径)。
重组也可能在真核生物有丝分裂时发生,它通常涉及染色体复制后形成的两个姐妹染色体。在这种情况下,由于姐妹染色体通常是相同的,所以不会产生新的等位基因组合。在减数分裂和有丝分裂中,DNA的相似分子(同源序列)之间发生重组。减数分裂过程中,非姐妹同源染色体相互配对,使非姐妹同源染色体之间发生典型的重组。在减数分裂和有丝分裂细胞中,同源染色体之间的重组是DNA修复中常见的机制。无性生殖的细菌和古菌也会发生基因重组和重组DNA修复。
对原核生物(例如细菌)来说,个体之间可以通过交接,或是经由病毒(例如噬菌体)的传送,来交换彼此的基因,并且利用基因重组,将这些基因组合到本身原有的遗传物质中。
对于较复杂的生物来说,重组通常是因为同源染色体配对时发生互换,使得同源染色体上的基因在遗传到子代时,经常有不完全的连锁。由于重组现象的存在,科学家可以利用重组率来定出基因之间的相对位置,描绘出基因图谱。
使同源序列相同的基因转换过程也属于基因重组。
联会
编辑在减数分裂期间,联会(同源染色体的配对)通常在基因重组之前发生。在一般减数分裂的步骤,先是联会 、再进行基因重组及分离(gene segregation)[2][3][4]。
机制
编辑基因重组由多种酶催化进行。重组酶是重组过程中催化链转移步骤的一种关键酶。大肠杆菌内发现的主要重组酶RecA负责修复DNA的双链断裂(double strand break(s),DSB(s))。在酵母和其他真核生物中,修复DSB需要两种重组酶。有丝分裂和减数分裂重组过程需要RAD51,而DNA修复蛋白DMC1专用于减数分裂重组。在古菌中,和细菌RecA蛋白的同源的是RadA。
染色体互换
编辑真核生物中,减数分裂期间的重组是通过染色体互换(或称交叉互换)进行的。交叉互换过程使后代拥有与亲本不同的基因组合,偶尔还会产生新的嵌合等位基因。基因的重组会增加遗传变异。它还允许有性繁殖的生物体避免穆勒棘轮效应,这种效应多用于指无性生殖种群的情况,随着时间的推移,其基因组中的有害突变往往会积累得比有益突变或复原突变更多。
染色体互换是指遗传自父母的成对染色体之间的重组,通常发生在减数分裂期间。在前期I期(粗线期),四条染色单体彼此紧密排列。而在这种结构中,两条染色单体上的同源位点可以配对,并可以交换遗传信息。[5]
由于染色体的每个位置上都有很小的概率发生重组,两个位置之间重组的频率取决于它们之间的距离(遗传连锁)。因此,对于同一染色体上相距足够远的基因,交叉互换的次数足以打破等位基因之间的相关性。
对遗传学家来说,追踪由交叉互换产生的基因的移动已经被证明是非常有用的。因为两个相距较近的基因比相距较远的基因更难分离,所以如果知道交叉互换的频率,遗传学家就可以推断出一条染色体上两个基因之间的大致距离。遗传学家也可以使用这种方法来推断某些基因的存在。若两个基因在重组过程中常保持在一起,则称二者之间存在遗传连锁。一个连锁对中的一个基因有时可以作为标记来推断另一个基因的存在。这通常用于检测致病基因的存在。[6]
观察得到的两个位点之间的重组频率称为交换值。它是两个连锁基因位点(遗传标记)之间发生染色体互换的频率,取决于观察的两个遗传位点之间相隔的距离。对于任何一组固定的遗传和环境条件,连锁结构(染色体)的特定区域的重组频率往往是固定的,而用于制作遗传图谱的交换值亦然。[7][8]
基因转换
编辑在基因转换中,遗传物质的一部分从一条染色体复制到另一条染色体,而来源染色体不变。减数分裂过程中,基因转换发生的频率很高。它是一个DNA序列从一个DNA螺旋(不变)复制到另一个DNA螺旋,后者序列被改变的过程。真菌杂交[9]中常进行基因转换研究,其中每次减数分裂形成的4个产物很容易观察。基因转换事件可以按照个体减数分裂中与正常的2:2分离模式的偏离(例如3:1分离模式)来区分。
非同源重组
编辑B细胞
编辑免疫系统的B细胞进行的基因重组,称为免疫球蛋白类型转换。这是一种将抗体从一类变成另一类的生物机制,例如,从一种叫做IgM的同种型变成IgG同种型。
基因工程
编辑基因工程中,重组也可以指人为地将完全不相关的DNA片段(往往来自不同生物体)重新组合,形成重组DNA。其中基因靶向是的对基因重组的一种常见应用,可用来增添、删除或改变一个生物体的基因。该技术在生物医学研究中有重要地位,它使得研究者能够研究特定基因的作用。基于基因重组的技术也应用于蛋白质工程中开发具有生物学意义的新蛋白质。
重组修复
编辑多种外源(如紫外线、X射线、化学交联剂)引起的DNA损伤可通过同源重组修复(homologous recombinational repair,HRR)得到恢复。[10][11]这些发现表明,自然过程(如正常代谢的副产物活性氧)产生的DNA损伤,也会得到同源重组修复。对人类而言,:减数分裂时同源重组修复所需的基因产物缺乏可能导致不育。[12]
减数分裂重组
编辑RNA病毒重组
编辑重组在生命起源中的作用
编辑Nowak和Ohtsuki[13]指出,生命起源也是生物演化的起源。他们指出,地球上所有已知的生命都是以生物聚合物为基础的,并提出生命起源的任何理论都必然涉及作为信息载体和催化剂的生物聚合物。Lehman[14]认为重组是一种进化的发展,和生命起源一样古老。Smail等人[15]提出,在原始地球上,重组在最初较短的信息聚合物(推测为RNA)的扩张中起到了关键作用,这些聚合物是生命的前身。
参见
编辑参考文献
编辑- ^ Daly, M J; Minton, K W. Interchromosomal recombination in the extremely radioresistant bacterium Deinococcus radiodurans.. Journal of Bacteriology. October 1995, 177 (19): 5495–5505. ISSN 0021-9193. PMC 177357 . PMID 7559335. doi:10.1128/jb.177.19.5495-5505.1995.
- ^ Hawley RS, Arbel T.,"Yeast genetics and the fall of the classical view of meiosis" (页面存档备份,存于互联网档案馆),PubMed - NCBI,1993 Feb 12;72(3):301-3.. PMID 8431941 DOI: 10.1016/0092-8674(93)90108-3
- ^ Peter B. Moens,"Molecular perspectives of chromosome pairing at meiosis" (页面存档备份,存于互联网档案馆),BioEssays - Wiley Online Library,Volume16,Issue2,February 1994,Pages 101-106.
- ^ 赵绍惠[1] 和 大卫摩亚[2] (页面存档备份,存于互联网档案馆)(Siu-Wai Chiu & David Moore),"解读真菌的形态发育--第六章(Deciphering Fungal Morphogenesis--Chapter 6)"[3] (页面存档备份,存于互联网档案馆),香港中文大学生命科学学院,2003.
- ^ Alberts B. Molecular Biology of the Cell, Fourth Edition. New York: Garland Science. 2002. ISBN 978-0-8153-3218-3.
- ^ Access Excellence. Crossing-over: Genetic Recombination. The National Health Museum Resource Center. [February 23, 2011]. (原始内容存档于2013-07-31).
- ^ Rieger R, Michaelis A, Green MM. Glossary of genetics and cytogenetics: Classical and molecular . Heidelberg - New York: Springer-Verlag. 1976. ISBN 978-3-540-07668-1.
- ^ King RC, Stransfield WD. Dictionary of Genetics.. New York, Oxford: Oxford University Press. 1998. ISBN 0-19-509442-5.
- ^ Stacey KA. Recombination. Kendrew J, Lawrence E (编). The Encyclopedia of Molecular Biology. Oxford: Blackwell Science. 1994: 945–950.
- ^ Baker BS, Boyd JB, Carpenter AT, Green MM, Nguyen TD, Ripoll P, Smith PD. Genetic controls of meiotic recombination and somatic DNA metabolism in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. November 1976, 73 (11): 4140–4. Bibcode:1976PNAS...73.4140B. PMC 431359 . PMID 825857. doi:10.1073/pnas.73.11.4140 .
- ^ Boyd JB. DNA repair in Drosophila. Hanawalt PC, Friedberg EC, Fox CF (编). DNA Repair Mechanisms. New York: Academic Press. 1978: 449–452.
- ^ Galetzka D, Weis E, Kohlschmidt N, Bitz O, Stein R, Haaf T. Expression of somatic DNA repair genes in human testes. Journal of Cellular Biochemistry. April 2007, 100 (5): 1232–9. PMID 17177185. S2CID 23743474. doi:10.1002/jcb.21113.
- ^ Nowak MA, Ohtsuki H. Prevolutionary dynamics and the origin of evolution. Proc Natl Acad Sci U S A. 2008 Sep 30;105(39):14924-7. doi: 10.1073/pnas.0806714105. Epub 2008 Sep 12. PMID 18791073; PMCID: PMC2567469
- ^ Lehman N. A case for the extreme antiquity of recombination. J Mol Evol. 2003 Jun;56(6):770-7. doi: 10.1007/s00239-003-2454-1. PMID 12911039
- ^ Smail BA, Clifton BE, Mizuuchi R, Lehman N. Spontaneous advent of genetic diversity in RNA populations through multiple recombination mechanisms. RNA. 2019 Apr;25(4):453-464. doi: 10.1261/rna.068908.118. Epub 2019 Jan 22. PMID 30670484; PMCID: PMC6426292
本条目引用的公有领域材料来自NCBI的文档《Science Primer》。
- Michael J. McDonald, Daniel P. Rice, Michael M. Desai: Sex speeds adaptation by altering the dynamics of molecular evolution. In: Nature. 2016, doi:10.1038/nature17143
外部链接
编辑- Animations – homologous recombination (页面存档备份,存于互联网档案馆): Animations showing several models of homologous recombination
- The Holliday Model of Genetic Recombination (页面存档备份,存于互联网档案馆)
- 医学主题词表(MeSH):Genetic+recombination
- Animated guide to homologous recombination. (页面存档备份,存于互联网档案馆)