鲁米诺
化合物
鲁米诺(英文:Luminol),或称发光胺、光敏灵、流明诺,是通用的发光化学试剂,与适当的氧化剂混合时会发出引人注目的蓝色光。它是白色至淡黄色的晶体,可溶于大多数有机极性溶剂,但不溶于水。
| 鲁米诺[1] | |
|---|---|
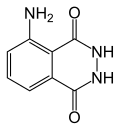
| |

| |
| IUPAC名 5-Amino-2,3-dihydro- 1,4-phthalazinedione | |
| 别名 | 发光胺,3-氨基邻苯二甲酰肼 |
| 识别 | |
| CAS号 | 521-31-3 |
| PubChem | 10638 |
| ChemSpider | 10192 |
| SMILES |
|
| InChI |
|
| InChIKey | HWYHZTIRURJOHG-UHFFFAOYAB |
| EINECS | 208-309-4 |
| 性质 | |
| 化学式 | C8H7N3O2 |
| 摩尔质量 | 177.16 g·mol⁻¹ |
| 熔点 | 319-320 ℃ |
| 危险性 | |
| NFPA 704 | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
化学
编辑合成
编辑3-硝基邻苯二甲酸可作为鲁米诺的合成原料。[2][3] 3-硝基邻苯二甲酸与肼在高沸点溶剂(如二甘醇)中发生缩合反应,失去一分子水,生成3-硝基邻苯二甲酰肼。然后以保险粉还原3-硝基邻苯二甲酰肼中的硝基,得到3-氨基邻苯二甲酰肼,即是鲁米诺。
化学发光
编辑鲁米诺只有用氧化剂处理过才会发光。通常使用双氧水和一种氢氧化物碱的混合水溶液作为激发剂。在铁化合物催化下,双氧水分解为氧气和水:
- 2 H2O2 → O2 + 2 H2O
实验室中常以铁氰化钾作为催化剂铁的来源,而法医学上的催化剂则恰好是血红蛋白中的铁。很多生物系统中的酶也可催化过氧化氢的分解反应。
鲁米诺与氢氧化物反应时生成了一个双负离子(Dianion,见图),它可被过氧化氢分解出的氧气氧化,产物为一个有机过氧化物。该过氧化物很不稳定,立即分解出氮气,生成激发态的3-氨基邻苯二甲酸。激发态至基态转化中,释放的能量以光子的形式存在,波长位于可见光的蓝光部分。
犯罪现场调查中的应用
编辑理论
编辑即使犯罪现场的血迹已经被擦过或清除过,法医依旧可以使用鲁米诺找到它们的位置。实际上,调查者在要调查的区域内喷洒鲁米诺和激发剂溶液, 再使用紫外光灯,血中的铁立即催化鲁米诺的发光反应,使其产生蓝色光芒。该反应需用的催化剂量非常少,因此鲁米诺可以检测痕量的血迹。发光大约持续30秒钟,可通过长曝光的照片观察出,其周围环境不可以太亮。
缺点
编辑鲁米诺有一些缺点限制了它的应用:
参考资料
编辑- ^ Merck Index, 11th Edition, 5470.
- ^ Huntress et al., J. Am. Chem. Soc., 1934, 241.
- ^ Synthesis of luminol 互联网档案馆的存档,存档日期2009-04-25.
- ^ Technical note about Hemaglow 互联网档案馆的存档,存档日期2008-10-26.
