魯米諾
化合物
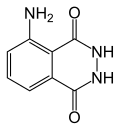
魯米諾(英文:Luminol),或稱發光胺、光敏靈、流明諾,是通用的發光化學試劑,與適當的氧化劑混合時會發出引人注目的藍色光。它是白色至淡黃色的晶體,可溶於大多數有機極性溶劑,但不溶於水。
| 魯米諾[1] | |
|---|---|
| |

| |
| IUPAC名 5-Amino-2,3-dihydro- 1,4-phthalazinedione | |
| 別名 | 發光胺,3-氨基鄰苯二甲酰肼 |
| 識別 | |
| CAS號 | 521-31-3 |
| PubChem | 10638 |
| ChemSpider | 10192 |
| SMILES |
|
| InChI |
|
| InChIKey | HWYHZTIRURJOHG-UHFFFAOYAB |
| EINECS | 208-309-4 |
| 性質 | |
| 化學式 | C8H7N3O2 |
| 摩爾質量 | 177.16 g·mol⁻¹ |
| 熔點 | 319-320 ℃ |
| 危險性 | |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
化學
編輯合成
編輯3-硝基鄰苯二甲酸可作為魯米諾的合成原料。[2][3] 3-硝基鄰苯二甲酸與肼在高沸點溶劑(如二甘醇)中發生縮合反應,失去一分子水,生成3-硝基鄰苯二甲酰肼。然後以保險粉還原3-硝基鄰苯二甲酰肼中的硝基,得到3-氨基鄰苯二甲酰肼,即是魯米諾。
化學發光
編輯魯米諾只有用氧化劑處理過才會發光。通常使用雙氧水和一種氫氧化物鹼的混合水溶液作為激發劑。在鐵化合物催化下,雙氧水分解為氧氣和水:
- 2 H2O2 → O2 + 2 H2O
實驗室中常以鐵氰化鉀作為催化劑鐵的來源,而法醫學上的催化劑則恰好是血紅蛋白中的鐵。很多生物系統中的酶也可催化過氧化氫的分解反應。
魯米諾與氫氧化物反應時生成了一個雙負離子(Dianion,見圖),它可被過氧化氫分解出的氧氣氧化,產物為一個有機過氧化物。該過氧化物很不穩定,立即分解出氮氣,生成激發態的3-氨基鄰苯二甲酸。激發態至基態轉化中,釋放的能量以光子的形式存在,波長位於可見光的藍光部分。
犯罪現場調查中的應用
編輯理論
編輯即使犯罪現場的血跡已經被擦過或清除過,法醫依舊可以使用魯米諾找到它們的位置。實際上,調查者在要調查的區域內噴灑魯米諾和激發劑溶液, 再使用紫外光燈,血中的鐵立即催化魯米諾的發光反應,使其產生藍色光芒。該反應需用的催化劑量非常少,因此魯米諾可以檢測痕量的血跡。發光大約持續30秒鐘,可通過長曝光的照片觀察出,其周圍環境不可以太亮。
缺點
編輯魯米諾有一些缺點限制了它的應用:
參考資料
編輯- ^ Merck Index, 11th Edition, 5470.
- ^ Huntress et al., J. Am. Chem. Soc., 1934, 241.
- ^ Synthesis of luminol 網際網路檔案館的存檔,存檔日期2009-04-25.
- ^ Technical note about Hemaglow 網際網路檔案館的存檔,存檔日期2008-10-26.
