臭氧
此条目需要补充更多来源。 (2014年7月23日) |
臭氧(英语:ozone)即三氧(trioxygen,化学式:O3),是氧的单质三原子分子,是氧气(双氧)的同素异形体,在常温下是一种有刺鼻味道的淡蓝色气体。臭氧的英语称呼源自希腊语的中性现在时分词 ozein (ὄζειν),意为“嗅”。
| 臭氧 | |||
|---|---|---|---|
| |||
| |||

| |||
| IUPAC名 Trioxygen | |||
| 英文名 | Ozone | ||
| 识别 | |||
| CAS号 | 10028-15-6 | ||
| PubChem | 24823 | ||
| ChemSpider | 23208 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | CBENFWSGALASAD-UHFFFAOYAY | ||
| Gmelin | 1101 | ||
| EINECS | 233-069-2 | ||
| ChEBI | 25812 | ||
| RTECS | RS8225000 | ||
| MeSH | Ozone | ||
| 性质 | |||
| 化学式 | O3 | ||
| 摩尔质量 | 47.998 [1] g·mol⁻¹ | ||
| 外观 | 浅蓝色气体[1] | ||
| 密度 | 0.002144 g/cm3 (0 ℃) 0.001962g/cm3(25 ℃)[1] | ||
| 熔点 | -193 ℃[1] | ||
| 沸点 | -111.35 ℃[1] | ||
| 溶解性(水) | 1.05 g/dm3 (0 °C) | ||
| 折光度n D |
1.2226(液态) | ||
| 结构 | |||
| 空间群 | C2v | ||
| 配位几何 | 对角线 | ||
| 分子构型 | 二面角 | ||
| 混成轨域 | sp2 for O1 | ||
| 偶极矩 | 0.53 D | ||
| 热力学 | |||
| ΔfHm⦵298K | 142.67 kJ·mol−1 | ||
| S⦵298K | 238.92 J·mol-1·K-1 | ||
| 危险性 | |||
| 欧盟分类 | |||
| NFPA 704 | |||
| 相关物质 | |||
| 相关化学品 | 二氧化硫 三硫 一氧化二硫 环臭氧 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
臭氧主要存在于距地球表面20公里的平流层下部的臭氧层中,含量约50ppm,主要由日光中的紫外线照射双氧产生光解而成,少量由大气层中的放电现象(闪电)电解产生。臭氧是一种比氧气更活跃的氧化剂,能吸收对生物细胞和遗传物质有害的短波紫外线,防止其到达地表。
发现
编辑1785年,德国人马丁·范·马伦在做实验时,发现发电机附近有股异味,但是他并没有继续研究下去。[2]1839年,另一德裔瑞士化学家克里斯提安·弗里德里希·尚班在做电解水实验亦发现特殊的臭味,[3]于是他以“ozone”来命名这种新气体,来源自希腊语“ozein”,意思是“臭味”,并于1840年在《哲学杂志》上发表相关他的发现。[4]
物理性质
编辑臭氧是一种淡蓝色气体,微溶于水,易溶于四氯化碳或碳氟化合物而显蓝色。在-112℃凝结成深蓝色的液体。温度低于-193℃,臭氧会形成紫黑色固体。
大多数人都可以嗅到有点类似氯刺鼻的气味。暴露在0.1-1 ppm的臭氧会产生头痛,眼睛灼热,刺激呼吸道。即使空气中有低浓度的臭氧,也会破坏有机材料,如橡胶、塑料,及动物的肺部组织。
性状
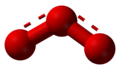
编辑臭氧具有等腰三角形结构,含有一个3中心4电子离域π键,三个氧原子分别位于三角形的三个顶点,顶角为116.79度,密度约为氧气的1.5倍,其沸点和凝固点均高于氧。臭氧在液态时呈现蓝紫色,在固态呈现紫色。[5]它与氧气不同,高浓度的臭氧带明显令人恶心的气味。但低浓度的臭氧闻起来就像下过雨后出门闻到的“新鲜空气”的那种气味,十分怡人。臭氧反应活性强,极易分解,很不稳定,在常温下会逐渐分解为氧气。臭氧性质比氧活泼,比重为一般空气的1.7倍。臭氧会因光、热、水分、金属、金属氧化物以及其他的触媒而加速分解为氧。
它不溶于液态氧等。有很强的氧化性,在常温下可将银氧化成氧化银,将硫化铅氧化成硫酸铅。臭氧可使许多有机色素褪色,对橡胶和纤维破坏性很大,很容易氧化有机不饱和化合物。臭氧在冰中极为稳定,其半衰期为2000年。
臭氧可利用碘化钾来检验。
臭氧能迅速且定量地氧化I−
成I
2,此反应也可以用来测定O
3的含量。[6]
臭氧能氧化CN−
故常被用来处理电镀工业中的含氰废水[6] :
由于它的强氧化性,亦可用于消毒杀菌剂。[6]
结构
编辑臭氧分子呈弯曲形对称结构。中心原子采取sp²杂化(混成),两个杂化轨道与其他两个氧原子形成两根σ键,另一杂化轨道容纳孤对电子,除此之外,互相平行的2pz轨道重叠形成三中心四电子的大π键。
臭氧分子可以结合一个电子形成臭氧根离子(O3-),所形成的化合物为离子型臭氧化合物。臭氧分子也可以形成臭氧链-O-O-O-,构成共价型臭氧化物,如O3F2。[7]
臭氧层
编辑在大气层中,氧分子因高能量的辐射而分解为氧原子(O),而氧原子与另一氧分子结合,即生成臭氧。臭氧又会与氧原子、氯或其他游离性物质反应而分解消失,由于这种反复不断的生成和消失,乃能使臭氧含量维持在一定的均衡状态,而大气中约有90%的臭氧存在于离地面15到50公里之间的区域,也就是平流层,在平流层的较低层,即离地面20到30公里处,为臭氧浓度最高之区域,是为臭氧层(ozone layer)。
用途与制备
编辑工业上,用干燥的空气或氧气,采用5-25kv的交流电压进行无声放电制取,用空气做氧源时会衍生出大量氮氧化合气体。目前最先进的臭氧制备方法为高能量紫外线光解空气而对应生成纯净的臭氧。另外,在低温下电解稀硫酸,或将液体氧气加热都可制得臭氧。大自然很容易产生臭氧,在打雷闪电时会产生几十万伏特的高压电,电离空气及有机物形成臭氧。臭氧能于短时间内将空气中的浮游细菌消灭,并能中和、分解毒气,去除恶臭。臭氧作为一种常温下的气态强氧化剂,能迅速弥漫到整个灭菌空间,灭菌不留死角,杀菌更彻底。因此臭氧可用于净化空气及饮用水、杀菌、处理工业废物和作为漂白剂。在一些游泳池以臭氧取代氯气做为消毒用途。
市面上有一部分的空气清净机(或活氧机)具有制造活氧的功能,其实活氧就是臭氧,因为臭氧对生物有危害,在使用时人跟宠物都不能在室内。
三聚体的三过氧化三丙酮分解也可以产生臭氧,但反应较为剧烈,不宜使用:
臭氧的灭菌原理:灭菌过程属生物化学氧化反应。臭氧能对细菌的细胞体直接氧化,即破坏其DNA而达到抑制的效果,对病毒的RNA亦有破坏作用;对各种毒素具有一定的氧化作用,降低其毒性。
- 臭氧能氧化分解细菌内部葡萄糖所需的酶,使细菌灭活死亡。
- 直接与细菌、病毒作用,破坏它们的细胞器和DNA、RNA,使细菌的新陈代谢受到破坏,导致细菌死亡。
- 透过细胞膜组织,侵入细胞内,作用于外膜的脂蛋白和内部的脂多糖,使细菌发生通透性畸变而溶解死亡。
臭氧对人体的影响
编辑臭氧具有强烈的刺激性,吸入过量对人体健康有一定危害。它主要是刺激和损害深部呼吸道,并可损害中枢神经系统,对眼睛有轻度的刺激作用。
臭氧吸入体内后,能迅速转化为活性很强的自由基-超氧基(O₂⁻),主要使不饱和脂肪酸氧化,从而造成细胞损伤。[8]
当大气中臭氧浓度为0.1mg/m3时,可引起鼻和喉头粘膜的刺激;臭氧浓度在0.1-0.2mg/m3时,引起哮喘发作,导致上呼吸道疾病恶化,同时刺激眼睛,使视觉敏感度和视力降低[来源请求]。臭氧浓度在2mg/m3以上可引起头痛、胸痛、思维能力下降,严重时可导致肺气肿和肺水肿。
此外,臭氧还会阻碍血液输氧功能,造成组织缺氧;使甲状腺功能受损、骨骼钙化,还可引起潜在性的全身影响,如诱发淋巴细胞染色体畸变,损害某些酶的活性和产生溶血反应。臭氧超过一定浓度,除对人体有一定毒害外,对某些植物生长也有一定危害。臭氧还可以使橡胶制品变脆和产生裂纹。臭氧对人体也有致畸性,母亲孕期接触臭氧可导致新生儿睑裂狭小发生率增多。[9]
参见
编辑参考文献
编辑- ^ 1.0 1.1 1.2 1.3 1.4 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–77. ISBN 1-4987-5428-7 (英语).
- ^ 陈兴汉; 廖品姗. 生物氧化醫學問與答. 台北: 汉珍. 2018-07-10. ISBN 9789869613583.
- ^ Schönbein, C. F. Lecture of 13 March 1839. Ber. Verh. Nat. Ges. Basel. 1838–1840, 4: 58.
- ^ Schönbein, C. F. On the Odour Accompanying Electricity and on the Probability of its Dependence on the Presence of a New Substance. Philosophical Magazine. 1840, 17: 293–294.
- ^ ChemicalForce. That's how liquid ozone explodes!. [2021-07-19]. (原始内容存档于2022-01-27).
- ^ 6.0 6.1 6.2 武汉大学 吉林大学等校编 曹锡章 宋天佑 王杏乔修订. 无机化学(第三版). 高等教育出版社. 1994-10: 573 [2017-10-22]. ISBN 978-7-04-004880-3 (中文).
- ^ 刘新锦等.无机元素化学 氧族元素.北京:科学出版社.2010.01 ISBN 978-7-03-026399-5
- ^ 王旭梅; 柳若安; 曹磊; 冯晶; 李燚佩; 孙建强. 《环境标志产品技术要求 食具消毒柜 (征求意见稿)》 编制说明 (PDF). 环境保护部环境发展中心(中日友好环境保护中心). 2017年9月 [2020-07-16]. (原始内容存档 (PDF)于2020-07-16).
- ^ 《常见有毒化学品应急救援手册》,中山大学出版社


