依諾肝素鈉
依諾肝素鈉(英語:Enoxaparin sodium)以Lovenox等商品名在市面上銷售,是一種抗凝劑(抗凝血藥),[10]用於治療和預防深靜脈栓塞(DVT)和肺栓塞(PE),也包括在懷孕期間和某些手術後使用。[10]它也用於治療急性冠狀動脈症候群(ACS)和心臟病患者,[10]和在血液透析期間使用。[7][9]此藥物透過皮下注射或靜脈注射方式給藥。[10]
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Lovenox、Clexane、Xaparin和其他 |
| 生物相似藥 | Arovi, Axberi,[1] Axberi HP,[1] Exarane,[2] Exarane Forte,[2] Enoxapo,[3] Inclunox, Inclunox HP, Inhixa, Noromby, Noromby HP, Redesca, Redesca HP, Thorinane |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a696006 |
| 核准狀況 | |
| 懷孕分級 | |
| 給藥途徑 | 皮下注射 , 靜脈注射 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物半衰期 | 4.5小時 |
| 識別資訊 | |
| CAS號 | 679809-58-6 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.029.698 |
| 化學資訊 | |
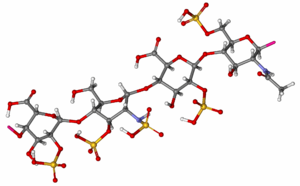
| 化學式 | (C26H40N2O36S5)n |
| 摩爾質量 | 4500 g/mol (average) |
使用後常見的副作用有出血、發燒和水腫。[10]出血可能導致嚴重的後果,特別是在進行腰椎穿刺之後。[10]懷孕期間使用似乎對胎兒安全。[10]依諾肝素鈉由肝素製成,[11]屬於低分子量肝素藥物家族。[10]
依諾肝素鈉於1981年研發成功,並於1993年獲得核准用於醫療用途。[11][10]它已被納入世界衛生組織基本藥物標準清單之中。[12]在市面上已有多個品牌,也有其通用名藥物流通。[10]此藥物於2020年在美國最常使用處方藥中排名第350,開立的處方箋數量超過50萬張。[13]
醫療用途
編輯- 與阿斯匹靈同時服用,以治療不穩定型心絞痛 (UA) 和非心電圖ST段升高型心肌梗塞 (NSTEMI)
- 臥床患者的DVT和PE預防
- 膝關節置換手術中的DVT預防
- 髖關節置換手術中的DVT預防
- 腹部手術中的DVT預防
- 伴隨或不伴隨肺栓塞的DVT治療
- 心電圖ST段升高型心肌梗塞 (STEMI) 患者住院的DVT治療[8]
- 凝血酶原時間國際標準化比值(INR)低於治療範圍患者的過渡治療(當患者使用口服抗凝劑的INR值低於預期的治療範圍時,醫師使用其他抗凝劑(如低分子量肝素)進行短期治療,以降低血栓形成風險。)
監控
編輯依諾肝素鈉具有可預測的吸收、生物利用度和體內分佈,通常個體使用後不需監測。然而在某些情況下進行監測對特殊族群(例如腎功能不全或肥胖者)可能有益。在此情況下,可測量抗Xa因子單位(衡量低分子肝素抗凝效果的指標,參見低分子量肝素#醫療用途)並調整劑量。[8]
逆轉劑
編輯硫酸魚精蛋白逆轉依諾肝素鈉抗凝血作用的效果會低於逆轉肝素的,只能中和大約60%的抗Xa因子作用。[8]
懷孕
編輯- 美國食品藥物管理局(FDA)將依諾肝素鈉歸為B類妊娠藥物,表示個體在懷孕期間使用將不會對胎兒兒造成傷害。[8]
- 依諾肝素鈉不會穿過胎盤,因此胎兒不太可能接觸到此藥物。[8]
- 曾有一些懷孕期間使用依諾肝素鈉婦女報告胎兒死亡的案例,但尚不清楚是否由此藥物導致。[8]
- 商品名為Lovenox的依諾肝素鈉注射液,為延長藥效,添加有苯甲醇作為防腐劑,每毫升含有15毫克。雖然Lovenox廣泛用於孕婦,但研究發現,早產嬰兒對苯甲醇的耐受性較差。若早產兒攝入過量苯甲醇(每天每公斤體重99至405毫克),可能引發嚴重的喘息症候群。。[8][14]
- 依諾肝素鈉用於預防血栓,但僅懷孕本身就會增加孕婦發生血栓的風險,即使用像依諾肝素鈉這樣的抗凝血劑,仍須十分謹慎。[8]
副作用
編輯不常見 (<1%)
常見 (>1%)
- 血小板減少症,可能與肝素誘發血小板減少症相關(接受至少五天治療的人的發生率為0.5-5.0%)[15]
- 血清轉氨酶升高:5.9%-6.1%[8]
- 對於接受腹部或大腸直腸手術的人:
- 對於接受髖關節或膝關節置換術的人:
- 對於急性疾病期間活動能力嚴重受限的人:
- 在接受深部靜脈血栓治療的患者中:
對出現頻率監測
黑框警告
編輯FDA於2013年10月發佈對依諾肝素鈉黑框警告[16]的修訂,[17]建議服用依諾肝素鈉者,在進行腰椎穿刺或神經軸麻醉中,放置和拔除脊髓導管之時需要謹慎,[18]或有必要延遲這些人的依諾肝素鈉(抗凝血劑)給藥,以降低脊髓或硬膜外血腫的風險,因為如此可能導致永久性或長期癱瘓。[18]具有血腫風險的患者可能與下述情況有關聯:留置性硬膜外導管、使用具抗血小板作用非類固醇抗發炎藥等藥物,或是曾進行硬膜外或脊髓穿刺,或有脊椎損傷、脊椎變形等病史。[17]FDA建議對高風險族群進行出血和神經系統變化監測。[17][19]
藥理學
編輯作用機轉
編輯依諾肝素鈉結合並增強抗凝血酶(一種循環抗凝血劑),形成複合物,不可逆地滅活凝血因子Xa。[20]由於藥物分子量低,它對IIa因子(凝血酶)的活性較肝素為低。[21]
藥物代謝動力學
編輯吸收:生物利用度(皮下注射)~ 100%[17] 分佈:分佈體積(抗Xa因子活性)= 4.3公升[17] 代謝:依諾肝素鈉在肝臟中經由脫硫和解聚之一,或是兩者代謝成低分子量物質。[17] 排除:單劑量皮下注射依諾肝素鈉的生物半衰期為4.5小時。[17]單劑量中約10–40%的活性和非活性片段由腎臟排出。[17]對於腎功能低下者,需根據腎功能調整劑量。[17]
藥品類別
編輯生物相似藥
編輯2016年9月,商品名為Inhixa和Thorinane的依諾肝素鈉獲准在歐盟作醫療用途。 [9][23]Thorinane後於於2019年10月退出市場。[24]
2017年3月,西班牙Laboratorios ROVI公司生產的依諾肝素鈉(商品名BECAT)取得在歐洲26個國家的銷售許可。現可在歐洲購得此產品。[25]
2020年10月,商品名為Noromby和Noromby HP的依諾肝素鈉在加拿大獲准用於醫療用途。[26]
2020年11月,商品名為Inclunox和Inclunox HP的依諾肝素鈉在加拿大獲准用於醫療用途。[27]
2020年12月,商品名為Redesca和Redesca HP的依諾肝素鈉在加拿大核准用於醫療用途。[28]
參考文獻
編輯- ^ 1.0 1.1 Summary Basis of Decision (SBD) for Axberi/Axberi HP. Health Canada. 2024-01-26 [2024-02-24]. (原始內容存檔於2024-02-24).
- ^ 2.0 2.1 2.2 2.3 Exarane/Exarane Forte. Therapeutic Goods Administration (TGA). 2023-08-07 [2024-07-04]. (原始內容存檔於2024-01-02).
- ^ 3.0 3.1 3.2 Enoxapo Australian prescription medicine decision summary. Therapeutic Goods Administration (TGA). 2020-02-28 [2020-08-17]. (原始內容存檔於2020-02-26).
- ^ Enoxaparin Use During Pregnancy. Drugs.com. 2019-07-15 [2020-08-16]. (原始內容存檔於2020-10-27).
- ^ AusPAR: Exarane/Exarane Forte. Therapeutic Goods Administration (TGA). 2024-03-04 [2024-03-31]. (原始內容存檔於31 March 2024).
- ^ Summary Basis of Decision - Elonox/Elonox HP. Health Canada. 2023-03-28 [2023-04-24]. (原始內容存檔於2023-04-25).
- ^ 7.0 7.1 Clexane Forte Syringes - Summary of Product Characteristics (SmPC). emc. [2020-10-12]. (原始內容存檔於2018-09-26).
- ^ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 8.11 8.12 8.13 8.14 8.15 8.16 8.17 Lovenox- enoxaparin sodium injection. DailyMed. U.S. National Library of Medicine. 2020-04-28 [2020-08-16]. (原始內容存檔於2020-08-24).
- ^ 9.0 9.1 9.2 Inhixa EPAR. European Medicines Agency (EMA). 2018-09-17 [2020-04-02]. (原始內容存檔於r 2020-10-29).
- ^ 10.00 10.01 10.02 10.03 10.04 10.05 10.06 10.07 10.08 10.09 Enoxaparin Sodium. The American Society of Health-System Pharmacists. [2016-12-08]. (原始內容存檔於2016-12-21).
- ^ 11.0 11.1 Northern Neonatal Network. Enoxaparin. Neonatal Formulary: Drug Use in Pregnancy and the First Year of Life. John Wiley & Sons. 2008: 96. ISBN 9780470750353. (原始內容存檔於2016-12-20) (英語).
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Enoxaparin - Drug Usage Statistics. ClinCalc. [2022-10-07]. (原始內容存檔於2022-11-07).
- ^ Gershanik J, Boecler B, Ensley H, McCloskey S, George W. The gasping syndrome and benzyl alcohol poisoning. The New England Journal of Medicine. November 1982, 307 (22): 1384–1388. PMID 7133084. doi:10.1056/NEJM198211253072206.
- ^ Levy JH, Tanaka KA, Hursting MJ. Reducing thrombotic complications in the perioperative setting: an update on heparin-induced thrombocytopenia. Anesthesia and Analgesia. September 2007, 105 (3): 570–582. PMID 17717208. S2CID 25103749. doi:10.1213/01.ane.0000277497.70701.47 .
- ^ "FDA-sourced list of all drugs with black box warnings (Use Download Full Results and View Query links.)". nctr-crs.fda.gov. FDA. Retrieved 2023-10-22.
- ^ 17.0 17.1 17.2 17.3 17.4 17.5 17.6 17.7 17.8 ENOXAPARIN SODIUM- enoxaparin sodium injection. DailyMed. U.S. National Library of Medicine. [2015-11-05]. (原始內容存檔於2015-10-19).
- ^ 18.0 18.1 Drug Safety and Availability - FDA Drug Safety Communication: Updated recommendations to decrease risk of spinal column bleeding and paralysis in patients on low molecular weight heparins. Center for Drug Evaluation and Research. U.S. Food and Drug Administration. [2015-11-05]. (原始內容存檔於2015-10-30).
- ^ Office of the Commissioner. Safety Information - Lovenox (enoxaparin sodium) injection. U.S. Food and Drug Administration. [2015-11-05]. (原始內容存檔於2016-03-04).
- ^ Alldredge BK, Corelli RL, Ernst ME, Guglielmo BJ, Jacobson PA, Kradjan WA, Williams BR. Koda-Kimble and Young's Applied Therapeutics: The Clinical Use of Drugs Tenth. Lippincott Williams & Wilkins. February 2012: 347–348. ISBN 978-1-60913-713-7.
- ^ Trevor AJ, Katzung BG, Masters SB. Basic & Clinical Pharmacology. McGraw-Hill Medical. 2012. ISBN 978-0-07-176401-8.
- ^ LowMolecularWeightHeparins. livertox.nih.gov. 2012 [2015-11-05]. PMID 31643176. (原始內容存檔於2015-08-28).
- ^ Thorinane EPAR. European Medicines Agency (EMA). 2018-09-17 [2020-04-02]. (原始內容存檔於2019-12-30).
- ^ Public statement on Thorinane: Cessation of validity of the marketing authorisation in the European Union (PDF). [2020-04-02]. (原始內容存檔 (PDF)於2021-08-28).
- ^ To The National Stock Market Commission (PDF). [2020-05-29]. (原始內容存檔 (PDF)於2021-08-28).
- ^ Summary Basis of Decision (SBD) for Noromby/Noromby HP. Health Canada. 2014-10-23 [2022-05-29]. (原始內容存檔於2022-05-30).
- ^ Summary Basis of Decision (SBD) for Inclunox/Inclunox HP. Health Canada. 2014-10-23 [2022-05-29]. (原始內容存檔於2022-05-30).
- ^ Summary Basis of Decision (SBD) for Redesca/Redesca HP. Health Canada. 22014-10-23 [2022-05-29]. (原始內容存檔於2022-05-30).