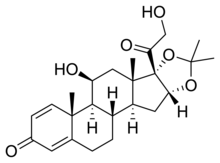
地奈德
地奈德是一種低效局部皮質類固醇抗炎藥,自1970年代開始面市。它主要用於治療成人和兒童的過敏性皮炎( 濕疹 ),脂溢性皮炎,接觸性皮炎和牛皮癬,並具有相當好的安全性[1] 。
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Desowen |
| 其他名稱 | Prednacinolone; Hydroxyprednisolone acetonide; Desfluorotriamcinolone acetonide; (11β,16α)-11,21-Dihydroxy-16,17-[(1-methylethylidene)bis(oxy)]-pregna-1,4-diene-3,20-dione |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a605025 |
| 給藥途徑 | topical |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 識別資訊 | |
| |
| CAS號 | 638-94-8 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.010.320 |
| 化學資訊 | |
| 化學式 | C24H32O6 |
| 摩爾質量 | 416.51 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
醫療用途
編輯地奈德是一種處方局部藥物,可治療各種皮膚病,如皮膚發紅,腫脹,騷癢和不適。不管使用哪種媒介,均需在相同的時間每天使用2至3次。在治療的前兩周內,皮膚狀況通常會改善。 患者應使用改善病情所需的最短時間的地奈德。 [2]
副作用
編輯尚未確定地奈德使用超過四周的安全性。[2] 對皮質類固醇(如氫化可的松或潑尼松)過敏的患者在使用地奈德時應格外小心。[3] 藥劑師和開處方的醫生應注意,這種藥物可能含有會引起過敏反應的其他成分。
如果治療區域有感染或開放性傷口,則不應使用地奈德。
局部皮質類固醇激素的全身吸收會產生不良反應。 在接受治療的一些患者中觀察到了庫欣綜合症,高血糖症和糖尿病的指征。停止治療後,可逆性的下視丘-垂體-腎上腺軸(HPA)抑制作用可能會導致糖皮質激素不足。 ACTH1-24實驗室測試可以評估患者的HPA抑制。 [2] 停止治療或用另一種效力較弱的皮質類固醇替代後,HPA功能可逆轉。 如果發生糖皮質激素不足,則可能需要補充糖皮質激素。
若發生以下地奈德的副作用需要立即與主治醫師聯繫:
- 皮膚起泡,灼熱,結皮、乾燥或剝落
- 塗抹部位灼傷,發癢,發紅,皮疹,腫脹或酸痛
- 皮膚潮紅或發紅
- 刺激
- 皮膚瘙癢,脫屑,嚴重發紅,酸痛或腫脹
- 皮膚脫皮
- 皮膚上出現深紅色,類疣狀斑點,特別是在臉上使用時
- 刺痛和灼熱
- 皮膚異常溫暖
隨著身體適應藥物,可能會消失的副作用:
- 身體疼痛或疼痛
- 發冷
- 咳嗽
- 呼吸困難
- 耳部充血
- 發熱
- 頭痛
- 失聲
- 鼻充血
- 流鼻涕
- 打噴嚏
- 咽喉痛
- 異常疲倦或虛弱
懷孕
編輯FDA已將地奈德標記為C類妊娠藥物。懷孕期間僅在絕對必要時使用地奈德。
哺乳
編輯目前尚不知道局部應用地松奈德是否可以進入母乳中。 口服類似藥物已被發現會進入母乳。母乳餵養前應諮詢開處方的醫生。
作用機理
編輯地奈德是一種合成的非氟化皮質類固醇,和其他外用皮質類固醇一樣具有抗炎,止癢和收縮血管的作用。 然而對於皮膚給藥途徑,這些作用的機理尚不清楚。 [4] 通過皮膚吸收後,皮質類固醇的藥代動力學途徑與靜脈注射的皮質類固醇相似。 通常認為皮質類固醇的作用機制為誘導磷脂酶A2抑制蛋白(脂皮質激素)產生。脂皮質激素可控制炎症物質的生物合成,如前列腺素和白三烯,也可抑制炎症物質的常見前體花生四烯酸。
相互作用
編輯引起輕微藥物不良相互作用的常見藥物包括:胰島素和二甲雙胍。 聯合檢查但未知會引起藥物相互作用的常見藥物包括:阿斯匹靈,Cymbalta(度洛西汀),魚油,對乙醯氨基酚,維生素B12,維生素C,維生素D3和Zyrtec。 [5]
歷史
編輯地奈德最早於1970年由Dome Laboratories以商品名Tridesilon引入美國。 [6]從被引入美國以來,其他幾個國家也引入了不同品牌名稱的地奈德,包括義大利,西班牙,英國和德國。 FDA於2006年9月16日首次批准了Connetics Corporation的VerdesoFoam®。 [7]
研究與臨床試驗
編輯地奈德在2006年進行了兩項主要臨床試驗後被FDA批准。 每個隨機雙盲對照研究組均包含582名兒童患者(年齡在3個月至18歲之間)。 [8] 每天兩次向患者局部用藥或安慰劑,持續四個星期。在第一項臨床試驗中,使用地奈德組44%的患者被成功治癒,而安慰劑組則為14%。 在第二項臨床試驗中,地奈德組有28%的患者被治癒,而安慰劑組則為6%。
FDA批准地奈德用於以下治療:接觸性皮炎,漆酚引起的皮炎,濕疹,盤狀紅斑狼瘡,,脂溢性皮炎,輕度皮疹,瘙癢,牛皮癬,扁平苔蘚,特應性皮炎,異位性皮炎,角質病。 [9]
參考資料
編輯- ^ Overview on desonide 0.05%: a clinical safety profile. Journal of Drugs in Dermatology. 2004, 3 (4): 393–7. PMID 15303783.
- ^ 2.0 2.1 2.2 2.3 Access Data FDA (PDF). FDA.gov. [December 1, 2015]. (原始內容存檔 (PDF)於2017-02-25). 引用錯誤:帶有name屬性「:1」的
<ref>標籤用不同內容定義了多次 - ^ desonide topical : Uses, Side Effects, Interactions, Pictures, Warnings & Dosing - WebMD. WebMD. [2015-11-30]. (原始內容存檔於2015-11-26) (美國英語).
- ^ Desonate (desonide) - Drug information from MediLexicon. www.medilexicon.com. [2015-11-30]. (原始內容存檔於2015-12-08).
- ^ Desonide topical Drug Interactions - Drugs.com. Drugs.com. [2018-07-12]. (原始內容存檔於2018-07-12) (美國英語).
- ^ Sittig, Marshall. Pharmaceutical Manufacturing Encyclopedia (PDF). Noyes Publications. 1988 [December 1, 2015]. (原始內容 (vanc)存檔於2007-10-23).
- ^ Verdeso (desonide) FDA Approval History - Drugs.com. www.drugs.com. [2015-12-01]. (原始內容存檔於2015-12-08).
- ^ Multicenter trial for long-term safety and efficacy comparison of 0.05% desonide and 1% hydrocortisone ointments in the treatment of atopic dermatitis in pediatric patients. Journal of the American Academy of Dermatology. July 1995, 33 (1): 74–7. PMID 7601950. doi:10.1016/0190-9622(95)90014-4.
- ^ Tridesilon Topical Cream 0.05pct Drug Medication Dosage Information. www.cvs.com. [2015-12-01]. (原始內容存檔於2015-12-08).