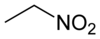
硝基乙烷
硝基乙烷是分子式為C2H5NO2的有機化合物。在許多方面與硝基甲烷相似,純硝基乙烷在一般條件下為無色、具有水果味的油性液體。
| 硝基乙烷 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 硝基乙烷 | |||
| 識別 | |||
| CAS號 | 79-24-3 | ||
| PubChem | 6587 | ||
| ChemSpider | 6338 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | MCSAJNNLRCFZED-UHFFFAOYAB | ||
| UN編號 | UN 2842 | ||
| ChEBI | 16268 | ||
| RTECS | KI5600000 | ||
| KEGG | C01837 | ||
| 性質 | |||
| 化學式 | C2H5NO2 | ||
| 摩爾質量 | 75.07 g·mol−1 | ||
| 密度 | 1.054 g/cm3 | ||
| 熔點 | -90 °C(183 K) | ||
| 沸點 | 115.0 °C(388 K) | ||
| 溶解性(水) | 4.6 g/100 mL(20 °C) | ||
| 蒸氣壓 | 21 mmHg (25 °C)[1] | ||
| pKa | 16.7[2][3] | ||
| 磁化率 | -35.4·10−6 cm3/mol | ||
| 黏度 | 6.77 泊(20 °C) | ||
| 危險性 | |||
GHS危險性符號  
| |||
| GHS提示詞 | 危險 | ||
| H-術語 | H226, H302, H315, H331, H341, H412 | ||
| P-術語 | P210, P261, P312, P301, P330, P304, P340, P312, P370, P378, P403+233 | ||
| 主要危害 | 可燃;有害 | ||
| NFPA 704 | |||
| 爆炸極限 | 3.4%-?[1] | ||
| PEL | TWA 100 ppm (310 mg/m3)[1] | ||
| 致死量或濃度: | |||
LC50(中位濃度)
|
5000 ppm(兔子,2 hr)[4] | ||
LCLo(最低)
|
6250 ppm(小鼠,2 hr)[1] | ||
| 相關物質 | |||
| 相關硝基化合物 | 1-硝基丙烷 2-硝基丙烷 | ||
| 相關化學品 | 亞硝酸乙酯 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
制備
編輯工業上可通過在350–450°C下用硝酸與丙烷反應來生產硝基乙烷。該放熱反應會產生四種工業上重要的硝基烷:硝基甲烷、硝基乙烷、 1-硝基丙烷和2-硝基丙烷。該反應涉及自由基形成,例如CH3CH2CH2O·(正丙氧基自由基),是通過相對應的亞硝酸酯均裂作用生成的。這些烷氧基自由基很容易發生碳碳單鍵斷裂反應,這解釋了反應產物是混合物的原因 。[5]
或者,可以通過鹵代乙烷(例如氯乙烷、溴乙烷或碘乙烷)與亞硝酸銀在乙醚或THF中的Victor Meyer反應來生成硝基乙烷。該反應的Kornblum修飾使用在二甲基亞碸或二甲基甲醯胺溶劑中的亞硝酸鈉做反應試劑。 [6]
用途
編輯透過亨利反應這樣的縮合反應,硝基乙烷可被轉化為幾種具有商業價值的化合物。若此化合物與3,4-二甲氧基苯甲醛縮合,可得到降血壓藥甲基多巴的前體;與未取代的苯甲醛縮合生成苯基-2-硝基丙烯。硝基乙烷與兩當量的甲醛縮合,氫化後可生成2-氨基-2-甲基-1,3-丙二醇,2-氨基-2-甲基-1,3-丙二醇與油酸縮合可生成噁唑啉,噁唑啉質子化生成陽離子表面活性劑。[5]
像其他一些硝化有機化合物一樣,硝基乙烷也被用作燃料添加劑和火箭推進劑的前體。
硝基乙烷是用於聚合物(例如聚苯乙烯)的有用溶劑,並且對於溶解氰基丙烯酸酯粘合劑特別有用。在化妝品應用中,它已被用作人造指甲去除劑和高架天花板密封膠噴霧劑的成分。
以前,硝基乙烷曾在實驗室中成功用作化學原料(前驅物),可用於合成多種物質和消費品,例如甲基安非他命,其使用在19世紀和20世紀很普遍(特別是在第二次世界大戰期間,盟軍和納粹皆用此藥物來刺激士兵情緒,對其食慾和睡眠抑制以及增強注意力,機敏性)。硝基烷烴是用於合成許多苯乙胺衍生物的許多成分之一,包括藥物如甲基安非他命和外消旋化合物安非他命 ,[7]一種治療肥胖的厭食藥。 [7]
毒性
編輯硝基乙烷被可能認為會造成基因損害,並對神經系統有害。典型的TLV/TWA為100 ppm。典型的STEL為150 ppm。皮膚接觸會導致人類患上皮炎。在動物研究中,觀察到硝基乙烷暴露會導致流淚,呼吸困難,呼吸異音,水腫,肝腎損害和麻痺。 [8] 曾有兒童因誤食人造指甲去除劑,攝取此化合物而中毒。 [9]
參考資料
編輯- ^ 1.0 1.1 1.2 1.3 NIOSH Pocket Guide to Chemical Hazards. #0453. NIOSH.
- ^ Reich, Hans. Bordwell pKa table: "Nitroalkanes". University of Wisconsin Chemistry Department. [2016-01-17]. (原始內容存檔於2008-10-09).
- ^ Matthews, Walter; et al. Equilibrium acidities of carbon acids. VI. Establishment of an absolute scale of acidities in dimethyl sulfoxide solution. Journal of the American Chemical Society. 1975, 97 (24): 7006. doi:10.1021/ja00857a010.
- ^ Nitroethane. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ 5.0 5.1 Sheldon B. Markofsky 「Nitro Compounds, Aliphatic」 in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a17_401.
- ^ Agrawal, Jai. Organic Chemistry of Explosives. Chichester, England: John Wiley & Sons. 2007: 7–10. ISBN 9780470029671.[失效連結]
- ^ 7.0 7.1 2016 National Drug Assessment Summary (PDF). Drug Administration. November 2016.[失效連結]
- ^ "Chemical Sampling Information Nitroethane.". [2021-04-01]. (原始內容存檔於2017-07-31).
- ^ Hornfeldt CS, Rabe WH. Nitroethane poisoning from an artificial fingernail remover. J. Toxicol. Clin. Toxicol. 1994, 32 (3): 321–4. PMID 8007041. doi:10.3109/15563659409017967.
- ^ MSDS for nitroethane (revised October 3, 2005), as reported by Fisher Scientific..