肾生理学
肾生理学(renal physiology[注 1])为肾的生理学研究,即研究肾脏的所有功能的学科。
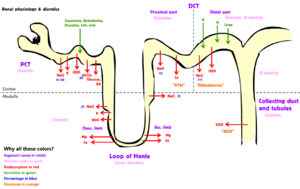
肾功能(renal function)包括葡萄糖、氨基酸,及其它小分子的再吸收;钠、钾及其它电解质的调节;体液平衡及血压调节;酸碱稳态的维持;各种激素的生成、包括红细胞生成素,及维生素D的活化。
肾生理概要
编辑肾生理机制术语 A WET BED
编辑〈A WET BED〉这些助忆符号辅助了解肾脏功能的机制;符号的各个字母解释如下:
A – 维持酸碱(ACID-base)平衡。W – 维持水(WATER)的平衡。E – 电解液(ELECTROLYTE)平衡。T – 毒素(TOXIN)去除。B – 血(BLOOD)压控制。E – 制造红细胞生成素(ERYTHROPOIETIN)。D – 维生素(D)代谢。
肾生理运作
编辑许多肾生理学在研究肾单位、即肾脏的最小功能单元之水平。每个肾单位具有一组过滤元件开始于过滤血液进入肾。然后该滤液沿着肾单位长度而进行,而肾单位长度是由专门的细胞单层衬里及毛细管围绕所成的管状结构。这些衬细胞的主要功能是将由滤液进入血液的水及小分子,并及从血液进入尿液的废物分泌进而再吸收。
肾的正常功能要求接受血液以及充分过滤血液。这在微观上是由数十万个称为肾小体的过滤单元所运作,每个过滤单元(肾小体)由肾小球和鲍氏囊所组成。肾功能之全面评估通常通过估算过滤速率来确定,称之为肾小球滤过率(GFR)。
肾的功能
编辑肾脏的功能可以分为三组:〈激素分泌〉、〈糖质新生作用〉(糖异生),以及pH与血液成分的〈细胞外稳恒性〉。肾单位是肾脏的功能单位。
激素分泌
编辑糖质新生作用
编辑人类肾脏能够从乳酸,甘油和谷氨酰胺产生葡萄糖。肾脏在人体空腹时担负大约全部糖异生作用的一半功能。通过胰岛素、儿茶酚胺及其它激素的作用来实现肾脏中葡萄糖制造的调节。[1]肾脏的糖异生产生在肾皮质中。由于缺乏必需的酶,肾髓质不能制造葡萄糖。[2]
细胞外稳恒性
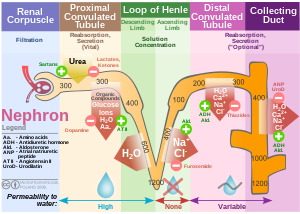
编辑肾脏是负责维持下列物质的平衡:
| 物质 | 说明 | 近曲小管 | 肾袢 | 远曲小管 | 收集管系统 |
| 肾葡萄糖再吸收 | 如果葡萄糖不被肾脏再吸收,就会出现在尿液中,称为肾性糖尿病。所以肾葡萄糖再吸收的运作与糖尿病有关.[3] | 经由钠依赖型葡萄糖共同运输蛋白(细胞膜)以及GLUT (细胞膜基底外侧)再吸收(几乎达100%)[4] | – | – | – |
| 肾小管液寡肽,肾小管液蛋白质,及氨基酸 | 所有这些都几乎都被完全吸收。[5] | 再吸收 | – | – | – |
| 肾尿素处理 | 渗透压调节。因ADH而变化[6][7] | 经由被动运输再吸收(50%) | 分泌 | – | 在髓质收集管(Medullary collecting duct)中再吸收 |
| 肾钠再吸收 | 使用钠氢逆向转运体、钠葡萄糖共转运体(Na-glucose symport)、钠离子通道(次要).[8] | 再吸收 (65%, 渗透浓度) | 再吸收(25%,升支粗段,钠钾氯共转运蛋白) | 再吸收 (5%,钠氯同向转运体) | 再吸收(5%,主要细胞),通过上皮钠通道(ENaC)由醛固酮刺激 |
| 肾氯化物再吸收 | 通常跟随着钠而运作。活性(穿越细胞传输)及被动性(旁细胞传输/并行传输)[8] | 再吸收 | 再吸收(升支粗段,钠钾氯共转运蛋白) | 再吸收(钠氯同向转运体) | – |
| 水 | 使用水通道蛋白。参见利尿剂。 | 与溶质一起吸收渗透 | 再吸收(降支) | – | 再吸收(由ADH调节,并经由,精氨酸加压素受体2) |
| 碳酸氢盐 | 有助于维持酸度系数平衡.[9] | 再吸收 (80–90%) [10] | 再吸收(升支粗段) [11] | – | 再吸收"闰细胞"(intercalated cells),经由带3带3阴离子转运蛋白及潘特林) |
| 质子 | 使用三磷酸水解酵素 | – | – | – | 分泌(闰细胞) |
| 钾 | 不同的饮食需求。 | 再吸收(65%) | 再吸收(20%,升支粗段,钠钾氯共转运蛋白) | – | 分泌(普通,经由钠钾泵,被醛固酮所提升),或则再吸收(罕见,钾钠腺苷三磷酸酶) |
| 钙 | 使用钙三磷酸腺苷酶、钠钙交换器 | 再吸收 | 经由被动运输再吸收(升支粗段) | 回应PTH而进行再新吸,以及"噻嗪利尿剂"(Thiazide Diuretics)↑再吸收的提升。 | – |
| 镁 | 钙和镁竞争,其中过量的一个可以导致另一个排泄出去。 | 再吸收 | 再吸收(升支粗段) | 再吸收 | – |
| 磷酸盐 | 排泄为可滴定酸. | 经由钠/磷酸盐转运蛋白再吸收(85%).[4]由副甲状腺素所抑制. | – | – | – |
| 羧酸盐 | 再吸收(100%[12])经由羧酸转运蛋白. | – | – | – |
身体对其pH值非常敏感。如果身体所需要的pH值在维生范围以外,蛋白质会变性且消化掉,酶也会失去其功能,如此身体就不能维持自身之运作。肾脏通过调节血浆的pH值来维持酸碱稳态。因此酸及碱的损失必须平衡。酸也分为"挥发性酸"[13]及"非挥发性酸"。[14] 另见可滴定酸。
维持这种稳定平衡的主要稳态控制点即是肾排泄。肾脏通过醛固酮,抗利尿激素(ADH或加压素),心房利钠肽(ANP)及其他激素等之作用的引导进而排泄或保留钠。部分钠排泄率异常范围的显现可能意味着急性肾小管坏死,或肾小球功能障碍。
肾生理机制
编辑1: 过滤,2: 再吸收,3: 分泌,4: 尿排泄。
〈尿排泄率(4))〉=〈过滤速度(1)−再吸收率(2)+分泌率(3)〉
肾脏执行其许多功能的能力取决于过滤、再吸收,以及分泌的三种基本功能,其总和功能称之为肾清除率或肾排泄率。亦即:
- 〈(尿排泄率)4)〉=〈过滤速度(1)−重吸收率(2)+分泌率(3)〉[15]
尽管在泌尿系统中的排泄一词之严格的词义本身就是排尿,但是肾清除率也通常被称为肾排泄(比如,在固定的术语中之部分钠排泄率)。
过滤
编辑血液通过肾脏的基本的功能单元肾元进行过滤。每个肾单位从一个肾小体开始,由一个封闭在鲍氏囊内的肾小球所组成。通过肾超滤过程将细胞,蛋白质和其他大分子从肾小球中过滤出来,留下类似血浆的超滤液(除了超滤液具有可忽略不计的血浆蛋白)以进入鲍氏囊腔。过滤是由斯塔林力量所驱动的。
超滤液依次通过近曲小管、亨利氏环、远曲小管,以及一系列收集管系统进而形成尿液。
再吸收
编辑肾小管再吸收是将溶质及水从肾小管液中去除并再吸收之肾小管液体流物质输送到血液的过程。这过程被称为再吸收(而不是吸收),一来因为这些物质已经被吸收了一次(特别是在胃肠道中);再则因为身体从正将成为尿液的"后肾小球液体流"回收(也就是说,除非液体流物质被回收,否则很快就会流失到尿液中)。
再吸收是一个二步骤的过程。开始于从主动运输或被动运输所提取的物质从小管流体进入肾间质( renal interstitium)(即围绕肾单位的结缔组织),然后将这些物质从间质输送到血液中。这些再吸收的输送过程是由斯塔林施力,扩散作用,以及主动运输所驱动。
间接再吸收
编辑在某些情况下,再吸收是间接性的。比如:碳酸氢盐(HCO3−)不具有转运蛋白,因此其再吸收涉及在小管腔和管状上皮中的一系列反应。它开始于通过钠氢反转运输器将氢离子(H+)活性分泌物输入到小管液中:
- 在管腔中
- H+与HCO3−结合形成碳酸(H2CO3) 。
- 腔内碳酸酐酶将H2CO3酶促转化为H2O及CO2 。
- CO2自由扩散到细胞中 。
- 在上皮细胞中
激素
编辑再吸收的一些关键调节激素包括:
两种激素主要在收集管系统(collecting duct system)里发挥其作用。
分泌
编辑管状分泌是将材料从肾小管周边微血管转移到肾小管腔。管状分泌主要由主动运输所引起。
本然地新陈代谢只有少数物质被分泌出来。这些物质以大量过量地出现,或为天然毒物。但是,许多药物通过肾小管来分泌清除(Table of medication secernated in kidney)。
肾功能的测量
编辑一个简单估计肾功能是方法是测量pH值、尿素氮、肌酸酐,以及碱性电解质(包括钠、钾、氯化物,以及碳酸氢盐)等参数值。由于肾脏是控制这些参数值的最重要的器官,这些参数值的任何紊乱现象都可能表明肾功能受到损害。
参与评估肾功能的几个正式测试法与比例值:
| 测量单位 | 计算表示式 | 细节说明 |
| 肾血浆流量 | [16] | 每单位时间输给肾脏的血浆容量积。PAH清除率是用于提供肾脏分析法的估计。大约是 625 ml/min. |
| 肾血流量 | (HCT 表血细胞压积) | 每单位时间输给肾脏的血液量。在人类中,在70公斤的成年男性中,肾脏一起获得约20%的心输出量,达到 1L/min。 |
| 肾小球滤过率 | (使用肌酐清除率估计) | 每单位时间从肾的肾小球毛细血管过滤到鲍氏囊的流量体积。估计使用菊粉。通常进行肌酐酸清除试验,但也可以使用其他标记物,例如植物性多糖菊粉或放射性标记EDTA。 |
| 滤过分数 | [17] | 测量过滤的肾血浆部分。 |
| 阴离子间隙 | AG = [Na+] − ([Cl−] + [HCO3−]) | 阳离子减阴离子。排除 K+ (经常),Ca2+,H2PO4−。艾滋病代谢性酸中毒的鉴别诊断 |
| 清除 (水之外) | 而 U = 浓度,V = 尿量 / 单位时间,U*V = 尿排泄,以及 P = 血浆浓度 [18] | 移除率 |
| 自由水清除率 | or [19] | 血浆容积即是每单位时"无溶液"水之清除率 (药理学)。 |
| 净酸排泄 | 单位时间尿中排泄出的净酸量 |
注释
编辑参考文献
编辑- ^ J. E. Gerich. Role of the kidney in normal glucose homeostasis and in the hyperglycaemia of diabetes mellitus: therapeutic implications. Diabetic Medicine. 2010-02-01, 27 (2): 136–142 [2018-04-02]. ISSN 1464-5491. doi:10.1111/j.1464-5491.2009.02894.x (英语).
- ^ J. E. Gerich, C. Meyer, H. J. Woerle, M. Stumvoll. Renal gluconeogenesis: its importance in human glucose homeostasis. Diabetes Care. 2001-2, 24 (2): 382–391 [2019-02-12]. ISSN 0149-5992. PMID 11213896. (原始内容存档于2016-06-05).
- ^ Sect. 7, Ch. 6: Characteristics of Proximal Glucose Reabsorption. lib.mcg.edu
- ^ 4.0 4.1 Sect. 7, Ch. 5: Cotransport (Symport). lib.mcg.edu
- ^ Sect. 7, Ch. 6: Proximal Reabsorption of Amino Acids: Site of Reabsorption. lib.mcg.edu
- ^ Sect. 7, Ch. 6: Proximal Reabsorption of Urea. lib.mcg.edu
- ^ V. Excretion of Organic Molecules. lib.mcg.edu
- ^ 8.0 8.1 VI. Mechanisms of Salt & Water Reabsorption 互联网档案馆的存档,存档日期2007-02-10.
- ^ Sect. 7, Ch. 6: Proximal Reabsorption of Bicarbonate. lib.mcg.edu
- ^ Sect. 7, Ch. 12: Proximal Tubular Reabsorption of Bicarbonate. lib.mcg.edu
- ^ Sect. 7, Ch. 12: Bicarbonate Reabsorption, Thick Limb of Henle’s Loop. lib.mcg.edu
- ^ Walter F., PhD. Boron. Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. 2005. ISBN 1-4160-2328-3. Page 799
- ^ Sect. 7, Ch. 12: Physiological Definition of Acids: Volatile Acid. lib.mcg.edu
- ^ Sect. 7, Ch. 12: Nonvolatile Acids. lib.mcg.edu
- ^ p 314, Guyton and Hall, Medical Physiology, 11th edition
- ^ Sect. 7, Ch. 4: Measurement of Renal Plasma Flow; Renal Clearance of PAH. lib.mcg.edu
- ^ Sect. 7, Ch. 4: Filtration Fraction. lib.mcg.edu
- ^ IV. Measurement of Renal Function. kumc.edu
- ^ Sect. 7, Ch. 8: Free water clearance (CH2O). lib.mcg.edu
延伸阅读
编辑- Gerich, J. E. (2010). "Role of the kidney in normal glucose homeostasis and in the hyperglycaemia of diabetes mellitus: Therapeutic implications". Diabetic Medicine 27 (2): 136–142. doi:10.1111/j.1464-5491.2009.02894.x. PMID 20546255