多替拉韋
多替拉韋(英語:dolutegravir,簡稱DTG)以商品名稱Tivicay(特威凱)等於市面上銷售,是一種抗反轉錄病毒藥物,用途為與其他藥物聯合,以治療愛滋病。[6]其他用途為預防暴露後的潛在愛滋病感染。[6]此藥物係透過口服方式給藥。[6]
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Tivicay及Tivicay PD |
| 其他名稱 | GSK572, S-349572 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a613043 |
| 核准狀況 | |
| 懷孕分級 | |
| 給藥途徑 | 口服給藥 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | n/a[4] |
| 血漿蛋白結合率 | ≥98.9% |
| 藥物代謝 | UDP-葡萄糖醛酸基轉移酶1-1及細胞色素P450 3A4酶CYP3A4 |
| 生物半衰期 | ~14小時 |
| 排泄途徑 | 糞便 (53%) 及尿液 (18.9%) |
| 識別資訊 | |
| |
| CAS號 | 1051375-16-6 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB配體ID | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.237.735 |
| 化學資訊 | |
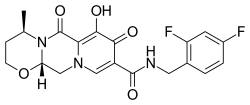
| 化學式 | C20H19F2N3O5 |
| 摩爾質量 | 419.38 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
使用後常見的副作用有睡眠困難、感覺疲倦、腹瀉、高血糖和頭痛。[7]嚴重的副作用有過敏反應和肝臟問題。[7]經進一步研究,個體於懷孕期間使用多替拉韋可能對嬰兒造成傷害的擔憂遭到推翻,這些研究顯示使用多替拉韋導致的神經管缺陷,與其他抗逆轉錄病毒藥相比沒有統計學上的差異。[8]目前尚不清楚個體於母乳哺育期間使用,對於嬰兒是否安全。[7]多替拉韋是一種愛滋病毒整合酶抑制劑,可阻斷病毒複製時所需的整合酶功能。[7]
多替拉韋於2013年在美國被批准用於醫療用途。[7]也被列入世界衛生組織基本藥物標準清單之中。[9]市面上有一種經核准用於治療愛滋病,稱為阿巴卡韋/度魯特韋/拉米夫定的複方藥,是多替拉韋加上阿巴卡韋和拉米夫定的組合。[7][10][11]截至2019年,世界衛生組織 (WHO) 建議將DTG作為所有愛滋病患者的第一線和第二線治療藥物。[12]
醫療用途
編輯多替拉韋被批准用於治療廣泛的愛滋病患者群體。它可用於從未接受過愛滋病治療藥物(稱為treatment-naïve)的成人患者,和先前接受過愛滋病治療藥物(稱為treatment-experienced)的成人患者,包括已接受過其他整合酶抑制劑治療的成人患者。 Tivicay也被批准用於12歲及以上,體重至少40公斤的兒童,這些兒童未接受過治療,或是曾接受過治療,但之前未使用過整合酶抑制劑類藥物。[13]
在歐盟是把多替拉韋與其他抗逆轉錄病毒藥物結合使用,用於治療感染愛滋病毒的成人、青少年和六歲以上兒童患者。[5]
美國於2020年6月把多替拉韋的適應症更新為包括至少4週大且體重至少3公斤(6.61磅)的兒童。[14]
不良影響
編輯在臨床試驗中,使用多替拉韋的常見副作用有失眠和頭痛。嚴重的副作用是同時感染B型肝炎或C型肝炎的患者會發生過敏反應和肝功能異常。[15]藥物包裝說明書列有黑框警告 - 由於藥物抑制腎小管分泌肌酸酐,使用者血清肌酸酐會平均升高0.11毫克/分升(mg/dL),但不影響腎絲球過濾率(GFR) 。[4]
懷孕
編輯人們於2019年曾短暫擔心過[16]個體於懷孕期間使用此藥物,可能會導致胎兒的神經管缺陷風險增加,但進一步研究發現多替拉韋和其他抗逆轉錄病毒藥物之間並無統計學差異,而將此疑慮推翻。 [8]截至2024年1月31日,[17]多替拉韋是美國國家衛生院 (NIH)對於懷孕或打算懷孕族群的首選抗逆轉錄病毒藥物。[18]
歷史
編輯美國食品藥物管理局(FDA)於2013年2月宣佈將加速多替拉韋的審核流程,[19]並於2013年8月13日批准其用於醫療用途。[20]多替拉韋於2013年11月4日獲得加拿大衛生部批准。[21]歐盟執行委員會於2014年1月16日批准此藥物可在整個歐盟使用。[5]
多替拉韋於2020年6月在美國獲得批准,適用於與其他抗病毒藥物聯合治療至少4週大且體重至少3公斤(6.61磅)兒童的愛滋病毒1型(HIV-1)感染 - 治療至少4週大、體重3公斤、從未接受過愛滋病治療,[14]或是已接受過治療但未使用過整合酶抑制劑類藥物的兒童。[14][22]
ViiV Healthcare製藥(迄2023年12月,為葛蘭素史克、輝瑞與鹽野義製藥三家共同投資的公司)生產的兩種商業品牌藥物 - Tivicay和Tivicay PD均獲得FDA頒發的適用醫療用途核准。[14]
取得
編輯哥倫比亞政府於2024年4月發佈有史以來首次的強制許可,讓藥廠得以生產多替拉韋的通用名藥物,[23][24]原因為雖然透過藥品專利池可取得製造該種藥物的授權,但哥倫比亞並不在授權範圍內。[25]聯合國愛滋病規劃署支持哥倫比亞採取的決定。[26]但ViiV Healthcare製藥對此強制許可並不同意。[27]而是與藥品專利池制定單獨協議,允許哥倫比亞分銷多替拉韋的通用名藥物,但僅限用於兒童治療。[28]
根據一份於2021年10月發表的文章,已有十家藥物製造商在藥品專利池與ViiV Healthcare製藥的授權下向低中收入國家供應WHO預先認證或FDA批准的通用名多替拉韋。[29]
氣候變化
編輯全球低收入和中等收入國家有2,400萬愛滋病患者使用多替拉韋,此藥物的製造較先前的護理標準藥物依非韋倫的可顯著減少碳排放。[30]這是第一份針對廣泛使用藥物與其替代品相比,所造成環境影響的報告。據全球性健康倡議組織聯合國愛滋病藥物機制稱,由於轉換用藥,將可在2017年至2027年間防止超過2,600萬噸二氧化碳排放進入大氣,相當於排除瑞士日內瓦為期10年的碳排放量。[31]
參見
編輯- ^ Dolutegravir (Tivicay) Use During Pregnancy. Drugs.com. 2018-10-16 [2020-02-13].
- ^ Prescription medicines: registration of new chemical entities in Australia, 2014. Therapeutic Goods Administration (TGA). 2022-06-21 [2023-04-10].
- ^ Drug and medical device highlights 2018: Helping you maintain and improve your health. Health Canada. 2020-10-14 [2024-04-17].
- ^ 4.0 4.1 4.2 Tivicay- dolutegravir sodium tablet, film coated. DailyMed. 2019-10-24 [2020-02-13].
- ^ 5.0 5.1 5.2 Tivicay EPAR. European Medicines Agency (EMA). 2018-09-17 [2020-02-13].
- ^ 6.0 6.1 6.2 British national formulary : BNF 69 69. British Medical Association. 2015: 429. ISBN 9780857111562.
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 Dolutegravir Sodium Monograph for Professionals. Drugs.com. [2019-04-20] (英語).
- ^ 8.0 8.1 Gill MM, Khumalo P, Chouraya C, Kunene M, Dlamini F, Hoffman HJ; et al. Strengthening the Evidence: Similar Rates of Neural Tube Defects Among Deliveries Regardless of Maternal HIV Status and Dolutegravir Exposure in Hospital Birth Surveillance in Eswatini.. Open Forum Infect Dis. 2023, 10 (9): ofad441. PMC 10502921 . PMID 37720700. doi:10.1093/ofid/ofad441.
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Ciccullo A, Baldin G, Borghetti A, Di Giambenedetto S. Dolutegravir plus lamivudine for the treatment of HIV-1 infection. Expert Review of Anti-infective Therapy. April 2020, 18 (4): 279–292. PMID 32067525. S2CID 211160876. doi:10.1080/14787210.2020.1729742.
- ^ Patel R, Evitt L, Mariolis I, Di Giambenedetto S, d'Arminio Monforte A, Casado J, et al. HIV Treatment with the Two-Drug Regimen Dolutegravir Plus Lamivudine in Real-world Clinical Practice: A Systematic Literature Review. Infectious Diseases and Therapy. August 2021, 10 (4): 2051–2070. PMC 8572911 . PMID 34426899. doi:10.1007/s40121-021-00522-7.
- ^ WHO recommends dolutegravir as preferred HIV treatment option in all populations. World Health Organization (新聞稿). [2019-07-22].
- ^ FDA approves new drug to treat HIV infection. Food and Drug Administration. 2013-08-12. (原始內容存檔於2014-02-08).
- ^ 14.0 14.1 14.2 14.3 FDA Approves Drug to Treat Infants and Children with HIV. U.S. Food and Drug Administration (FDA) (新聞稿). 2020-06-12 [2020-06-12].
- ^ U.S. FDA approves GlaxoSmithKline's HIV drug Tivicay. Reuters. 2013-08-12 [2020-02-13].
- ^ Consolidated Guidelines on HIV Prevention, Testing, Treatment, Service Delivery and Monitoring: Recommendations for a Public Health Approach. World Health Organization. 2020-10-29 [2024-07-15].
- ^ What to Start: Initial Antiretroviral Regimens During Pregnancy for People Who Are Antiretroviral-Naïve. Clinicalinfo. 2024-01-31 [2024-07-15].
- ^ Case-Specific Use of Antiretroviral Drugs in Pregnant and Nonpregnant People Trying to Conceive. Clinicalinfo. [2024-07-15].
- ^ GSK wins priority status for new HIV drug in U.S. Reuters. 2013-02-16 [2013-02-18]. (原始內容存檔於2013-02-19).
- ^ Drug Approval Package: Tivicay (dolutegravir) Tablets NDA #204790. U.S. Food and Drug Administration (FDA). 2013-09-13 [2020-06-12].
- ^ ViiV Healthcare receives approval for Tivicay (dolutegravir) in Canada for the treatment of HIV (PDF). [2013-11-11]. (原始內容 (PDF)存檔於2013-11-12).
- ^ ViiV Healthcare announces US FDA approval of the first-ever dispersible tablet formulation of dolutegravir, Tivicay PD, a once-daily treatment for children living with HIV. GSK (新聞稿). [2020-06-12].
- ^ Silverman, Ed. Colombia issues a compulsory license for an HIV medicine and 'plants a flag for global health equity'. STAT. 2024-04-25 [2024-07-28] (美國英語).
- ^ Colombia Issues Compulsory License To Enable It To Access Generic HIV Drug, Dolutegravir - Health Policy Watch. 2024-04-25 [2024-07-28] (美國英語).
- ^ More than 100 low- and middle-income countries have now received the WHO-recommended treatment for HIV thanks to access-oriented voluntary licensing agreements - MPP. [2024-07-28] (美國英語).
- ^ UNAIDS welcomes new decision in Colombia allowing more affordable access to quality HIV medicines. UNAIDS. 2023-10-04 [28 July 2024].
- ^ ViiV Healthcare statement on compulsory licence for dolutegravir in Colombia. viivhealthcare.com. [2024-07-28] (英國英語).
- ^ DOLUTEGRAVIR - PAEDIATRICS (DTG) - MPP. [2024-07-28] (美國英語).
- ^ Giten Khwairakpam. Thailand’s switch to dolutegravir: more generic versions needed!. medicines patent pool. 2021-10-29 [2024-10-11].
- ^ Shetty, Disha. World’s Leading HIV Drug Reduces Carbon Emissions by 26 Million Tons In Comparison to Predecessor. Health Policy Watch. 2024-07-15.
- ^ New Unitaid report: World’s leading HIV drug proven to have reduced global CO2 emissions by 26 million tons. UNITAID. 2024-07-15.