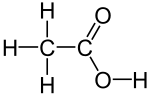
乙酸
乙酸(英語:ethanoic acid)又稱醋酸(英語:acetic acid),化學式為CH3COOH,是一種有機一元酸和短鏈飽和脂肪酸,為食醋酸味及刺激性氣味的來源。近乎無水的純乙酸(含水量1%以下)稱為「冰醋酸」,為無色的吸濕性晶體,凝固點為16~17℃(62℉)。儘管乙酸是一種弱酸,但是它具有腐蝕性,其蒸汽對眼和鼻有刺激性作用,聞起來有一股刺鼻的酸臭味。
| 乙酸 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 Acetic acid | |||
| 系統名 Ethanoic acid | |||
| 別名 | 醋酸 | ||
| 識別 | |||
| 縮寫 | HOAc | ||
| CAS號 | 64-19-7 | ||
| PubChem | 176 | ||
| ChemSpider | 171 | ||
| SMILES |
| ||
| Beilstein | 506007 | ||
| Gmelin | 1380 | ||
| 3DMet | B00009 | ||
| UN編號 | 2789 | ||
| EINECS | 200-580-7 | ||
| ChEBI | 15366 | ||
| RTECS | AF1225000 | ||
| DrugBank | DB03166 | ||
| KEGG | D00010 | ||
| MeSH | Acetic+acid | ||
| IUPHAR配體 | 1058 | ||
| 性質 | |||
| 化學式 | CH3COOH | ||
| 摩爾質量 | 60.05 g·mol⁻¹ | ||
| 外觀 | 無色液體或晶體 | ||
| 密度 | 1.049 g·cm−3 (l) 1.266 g·cm−3 (s) | ||
| 熔點 | 16-17 °C(289-290 K)(289.6 K, 61.6 °F) | ||
| 沸點 | 118-119 °C(391-392 K)(391.2 K, 244.5 °F) | ||
| 溶解性(水) | 混溶 | ||
| 溶解性 | 乙醇、丙酮中完全可溶,甲苯、己烷中完全可溶,二硫化碳中幾乎不溶 | ||
| log P | -0.322 | ||
| pKa | 4.76 (25℃) | ||
| pKb | 9.198 | ||
| 黏度 | 1.22 mPa·s(25℃) | ||
| 結構 | |||
| 偶極矩 | 1.74 D (g) | ||
| 熱力學 | |||
| ΔfHm⦵298K | -483.5 kJ/mol | ||
| S⦵298K | 158.0 J/mol/K | ||
| 熱容 | 123.1 J/mol/K | ||
| 危險性 | |||
| 警示術語 | R:R10-R35 | ||
| 安全術語 | S:S1/2-S23-S26-S45 | ||
| 主要危害 | 有腐蝕性 有刺激性 | ||
| NFPA 704 | |||
| 閃點 | 40℃ | ||
| 自燃溫度 | 400 °C | ||
| 致死量或濃度: | |||
LD50(中位劑量)
|
3.31 g·kg-1, 大鼠 (口服) | ||
| 相關物質 | |||
| 相關羧酸 | 甲酸、丙酸、丁酸 | ||
| 相關化學品 | 乙酰胺、乙酸乙酯、乙酰氯、乙酸酐、乙腈、乙醛、乙醇、硫代乙酸、乙酰膽鹼、乙酰膽鹼酯酶 | ||
| 附加數據頁 | |||
| 結構和屬性 | 折射率、介電系數等 | ||
| 熱力學數據 | 相變數據、固、液、氣性質 | ||
| 光譜數據 | UV-Vis、IR、NMR、MS等 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
乙酸是第二簡單的羧酸(僅次於甲酸),其分子由一個甲基一個羧基構成。乙酸是一種重要的化學試劑;在化學工業中,它被用來製造聚對苯二甲酸乙二酯,後者即飲料瓶的主要成分。乙酸也被用來製造電影膠片所需要的醋酸纖維素和木材用膠粘劑中的聚乙酸乙烯酯,以及很多合成纖維和織物。家庭中,乙酸稀溶液常被用作除垢劑。食品工業方面,乙酸是歐盟食品添加劑列表規定的一種酸度調節劑,編號為E260。
每年世界範圍內的乙酸需求量在650萬噸左右。其中大約150萬噸是循環再利用的,剩下的500萬噸通過石化原料直接製取或通過生物發酵製取。
命名
編輯乙酸(英語:acetic acid)既是常用名也是國際化聯(IUPAC)推薦的學名[1],來自拉丁文中的表示醋的詞「acetum」。在中文世界中亦使用俗名醋酸。無水乙酸在略低於室溫的溫度下(16.7℃),能夠轉化為一種具有腐蝕性的冰狀晶體,故常稱幾乎不含水的乙酸為冰醋酸(英語:glacial acetic acid)[2]。
乙酸的實驗式(最簡式)為CH
2O,分子式為C
2H
4O
2,結構簡式常寫為CH
3–COOH或CH
3COOH。乙酸失去一當量的氫正離子(H+
)後形成的離子稱為乙酸根離子(CH
3COO−
)。乙酸最常用的縮寫是AcOH或HOAc,其中Ac代表了乙酸中的乙酰基(CH
3CO)[3]。在書寫酸鹼中和反應時也可以用HAc表示乙酸,其中Ac代表了乙酸根離子[4]。
研究史
編輯早期研究
編輯乙酸發酵細菌(醋酸桿菌)在世界的各個角落均有分佈,故每個民族在釀酒實踐中均不可避免地會發現醋——它是酒精飲料暴露於空氣後的自然產物。在中國就有杜康的兒子黑塔因釀酒時間過長得到醋的說法[5]。乙酸在化學中的運用可以追溯到很古老的年代。早在公元前3世紀,古希臘哲學家泰奧弗拉斯托斯就詳細描述了醋是如何與金屬發生反應生成美術上要用的顏料的,例如白鉛(碳酸鉛)和銅綠(含乙酸銅之銅化合物混合物)。[6]古羅馬人發現將發酸的酒放在鉛制容器中煮沸能得到一種高甜度的「糖漿」,稱之為「sapa」;其富含一種有甜味的物質鉛糖,即乙酸鉛。飲用該種「糖漿」導致諸多羅馬貴族罹患鉛中毒。8世紀時,波斯鍊金術士賈比爾用蒸餾法濃縮了醋中的乙酸。[7]
文藝復興時期的鍊金術士通過重金屬乙酸鹽的乾餾製得了冰醋酸。16世紀德國鍊金術士安德烈亞斯·利巴菲烏斯就描述了這種方法,並比較了由此法製備的冰醋酸和醋中提取的酸的性質差異。水的存在令乙酸的性質巨變,以至於在幾個世紀裏,化學家們都認為冰醋酸和醋中的酸是截然不同的物質。法國化學家拉瓦錫甚至猜測冰醋酸是醋中酸的氧化產物。1797年,法國化學家皮埃爾·阿迪通過實驗證明兩者的差異不過是含水量不同而已。[6][8][9]
化學合成與表徵
編輯1815年,瑞典化學家約恩斯·貝爾塞柳斯通過對乙酸鉛的化學分析,依當時的原子量系統( =6, =8)給出了乙酸的「化學式」 。貝爾塞柳斯利用電化二元理論將乙酸解釋為碳氫「自由基」 之「三氧化物」,乙酸鹽則被他解釋為「帶負電性」的乙酸和「帶正電性」的鹼的「加成產物」:例如,乙酸鉀為 。[10][11]
1838年,法國化學家讓-巴蒂斯特·杜馬將乙酸與氯氣反應,製得了三氯乙酸;他發現三氯乙酸與乙酸的化學性質高度相似。1842年,杜馬的助手,法國化學家路易·梅森發現三氯乙酸還原後又重新生成乙酸。鑑於根據電化二元論提出的乙酸結構式無法解釋上述實驗現象,貝爾塞柳斯轉而認為乙酸由「甲基」 和「草酸基」 結合而成,即 。[10][11]
1843年至1847年,德國化學家阿道夫·威廉·赫爾曼·科爾貝對有機氯化物展開了研究。在研究中,科爾貝證實以無機物乃至單質為原料可以合成乙酸[6]。合成路線包括以下步驟:碳單質與二硫化鐵反應生成二硫化碳;氯化二硫化碳得四氯化碳;接着將製得的四氯化碳高溫裂解,生成四氯乙烯;進而將製得的四氯乙烯在日光照射下用氯水處理,得到三氯乙酸;最後一步電解還原三氯乙酸,即得乙酸。該路線的每一步反應均被科爾貝本人或早前其他人的工作證實為可行。這一結果有力地駁斥了「有機物需藉『生命力』(拉丁語:vis vitalis)方能製造」之理論;科爾貝稱其揭示了「乙酸,這種到目前為止僅被認為是有機質氧化產物的物質,可以輕而易舉地『合成』(德語:Synthese)出來」的有趣事實。[12][13]此乃「合成」一詞首度見諸有機化學文獻。[11][14]
1847年,科爾貝與愛德華·弗蘭克蘭發現乙腈鹼水解可製得乙酸。當時已知氰水解的產物為草酸;科爾貝據此斷定乙酸等脂肪族羧酸中存在「草酸基」。1849年,科爾貝通過分析乙酸鹽電解產物,進一步證實了貝爾塞柳斯早前提出的乙酸「結構式」。[12][14]
另一方面,早在1843年法國化學家查爾斯·弗雷德里克·格哈特就發現,按照當時的約定書寫的有機反應式中,水這樣的無機物總是成對出現;他據此推測有機物的式量實為當時公認值的一半。1851年,英國化學家亞歷山大·威廉·威廉姆遜依據其研究醇類的結果,指出乙酸分子是水分子中一個氫為 所取代的產物,而非如貝爾塞柳斯所預言的那樣本身含有一當量的水;他同時預言了水分子中兩個氫都被取代的產物——乙酸酐的存在。1852年,格哈特製備了乙酸酐,還製備了乙酸-苯甲酸酐這樣的混酐,從而證實了威廉姆遜提出的結構。儘管如此,由於原子量系統和符號系統尚未統一,在這一時期的文獻中,乙酸的化學式仍然五花八門。德國化學家凱庫勒的著作中摘錄的乙酸化學式竟有十九種之多(如左圖所示)。直至1860年卡爾斯魯厄會議召開,與會化學家們普遍接受斯坦尼斯勞·坎尼扎羅「應遵循阿伏加德羅的設想,以氣體密度定分子量」的意見後,情況才有所改觀。[10][11][15]
工業生產
編輯19世紀前,人類製造的絕大部分乙酸都是以食醋的形式,通過糖類發酵生產的。19世紀後半葉出現了木材乾餾工藝,木焦油(含有約5%至8%的乙酸)成為了食醋之外乙酸的另一來源;1910年時,大部分的冰醋酸提取自木焦油。該工藝先以氫氧化鈣處理木焦油,從中分離出乙酸鈣;用硫酸酸化乙酸鈣即得乙酸。這一時期,德國年生產萬餘噸冰醋酸,其中30%被用來製造靛青染料。[16][17]20世紀10年代,乙醛氧化工藝投入生產,拉開了以化學合成方法工業生產乙酸的序幕。20世紀50至70年代,丁烷-石腦油氧化工藝逐步投產,並因原料石腦油的低廉成本而成為了乙酸生產的重要工藝;1973年時,40%的乙酸以此工藝生產。1963年,巴斯夫公司開發了以鈷鹽為催化劑的甲醇羰基化工藝;孟山都公司則在1968年發明了銠基催化劑體系下的甲醇羰基化工藝——孟山都工藝,並在20世紀70年代將其商業化。甲醇羰基化工藝問世後,迅速取諸氧化工藝而代之,成為今日乙酸工業生產的主流工藝。[6][18]
物理性質
編輯乙酸在常溫常壓下是一種有強烈刺激性酸味的無色液體,其凝固點為16.6 °C(289.8 K),沸點117.9 °C(391.0 K),相對密度1.05。不純的乙酸通常含水,有時也會含有少量的乙醛、乙酸酐、甲酸等其他雜質。純乙酸在略低於室溫時會凝結成冰狀晶體,水-乙酸體系的共晶點溫度則低達-26℃。由於水的存在會顯著降低乙酸的凝固點,可通過測凝固點來推算其純度。[6][19]
結構
編輯乙酸晶體屬正交晶系,空間群Pna21。X射線繞射結果表明,在乙酸晶體內部,乙酸分子通過氫鍵相互締合形成長鏈;分子內兩個碳原子與兩個氧原子共平面,相鄰分子間則為異面關係。[20] 氣相中,乙酸分子則通過氫鍵兩兩締合成中心對稱的環狀二聚體(如右圖所示)。[18]該種二聚體穩定性較高,解離焓約為:[21]
二聚體的存在令乙酸蒸汽的密度遠大於根據其分子量計算得到的值。其它低級羧酸(如甲酸)在固相和氣相中也通過氫鍵形成結構類似的締合物。[6][20]至於液相中乙酸的超分子結構,目前學界尚缺乏共識:一些理論計算和實驗結果表明乙酸主要以二聚體的形式存在,另一些卻表明乙酸主要以長分子鏈的形式存在,還有一些則認為單體、寡聚體和分子鏈並存。[22]
溶劑性質
編輯液態乙酸是親水質子性極性溶劑。由於締合結構的存在,液態乙酸的極性並不強,其相對介電常數只有6.2。依相似相溶原理,乙酸並非強極性溶質的良好溶劑,但實驗結果表明部分強極性溶質(如無機鹽)仍或多或少可溶於乙酸:硝酸鋰、硝酸鈣、硝酸銨易溶於乙酸,而鹵化鈉、鹵化鉀、鹵化銨僅微溶於乙酸。液態乙酸較弱的極化能力也使得分散於乙酸中的離子間的具有較強的相互作用。這導致一些在水溶液中完全電離的強電解質在乙酸溶液中僅能部分電離,從而部分甚至大部分以分子或離子對的形式存在。因此,一些在水溶液中被「拉平」的強酸在乙酸溶液中得以區分出強弱;乙酸溶液中鹽效應亦十分顯著。[23][24][25][26][27]對於有機溶質而言,乙酸則是一種優良的溶劑。此外,乙酸自身與水、乙醇、乙醚等其它溶劑混溶,在多數有機溶劑中可溶,但難溶於二硫化碳。[19][28]
化學性質
編輯酸鹼性
編輯乙酸是一元羧酸。其羧基氫能夠電離為氫離子(質子),從而呈現酸性。乙酸在水溶液中是弱酸,酸度係數pKa=4.75(25℃)[6],略強於碳酸;濃度為0.1mol/L的乙酸溶液中,僅有約1%的乙酸分子電離[29]。
乙酸具有酸的通性,可與鹼金屬/鹼土金屬氫氧化物發生酸鹼中和反應,也能與碳酸鹽、碳酸氫鹽發生反應;產物均為乙酸鹽:[6][19]
乙酸的鹼性極其微弱。若且唯若遇到超強酸時,乙酸才能充當質子受體。 [6]
有機反應
編輯乙酸具有羧酸的通性,能參與諸多有機反應:乙酸可與五氯化磷或氯化亞碸反應,生成乙酰氯;可在濃硫酸存在下與醇類發生酯化反應,生成乙酸酯;還可在脫水劑(如五氧化二磷)的作用下脫水生成乙酸酐:[19]
乙酸可被氫化鋁鋰還原,產物為乙醇。此外,乙酸含有α氫,可在赤磷存在下與鹵素單質發生α-鹵代反應,生成單鹵代、雙鹵代乃至三鹵代乙酸:[19]
440℃的高溫下,乙酸發生熱裂解,反應途徑有兩條:一是生成甲烷和二氧化碳;二是生成乙烯酮和水。在伽瑪射線或電子束的作用下,乙酸也會分解成上列產物。電子迴旋共振可將乙酸直接分解成碳單質,並以金剛石薄膜的形式將之沉積於器壁上。[6]
鑑別
編輯乙酸可與三氯化鐵發生顯色反應,生成深紅色的產物乙酸鐵。該反應非常靈敏,既可以用於乙酸的定性分析,也可藉由比色法用於乙酸的定量分析[30]。將乙酸與氨水和硝酸鑭溶液混合後會得到深藍色的溶液,該顯色反應亦能用於乙酸的定性分析。此外,乙酸也可通過酯化反應來鑑別:將試樣與乙醇和濃硫酸混合後煮沸,若試樣為乙酸,則會生成具有芳香氣味的產物乙酸乙酯。[31]
製備
編輯乙酸的製備可以通過人工合成和細菌發酵兩種方法。75%的化工用乙酸是通過甲醇的羰基化製備。現在,生物合成法,即利用細菌發酵,僅佔整個世界產量的10%,但是仍然是生產醋的最重要的方法,因為很多國家的食品安全法規規定食物中的醋必須是由生物製備的。其他製備方式有:甲酸甲酯異構法、水煤氣合成法、氣相乙烯或乙醇氧化法。[32]
整個世界生產的純乙酸每年大概有500萬噸,其中一半是由美國生產的。歐洲現在的產量大約是每年100萬噸,但是在不斷減少。日本每年也要生產70萬噸純乙酸。每年世界消耗量為650萬噸,除了上面的500萬噸,剩下的150萬噸都是回收利用的[33][34] 。
發酵法
編輯有氧發酵
編輯在人類歷史中,以醋的形式存在的乙酸,一直是用醋桿菌屬細菌製備。在氧氣充足的情況下,這些細菌能夠從含有酒精的食物中生產出乙酸。通常使用的是蘋果酒或葡萄酒混合穀物、麥芽、米或馬鈴薯搗碎後發酵。有這些細菌達到的化學方程式為:
做法是將醋菌屬的細菌接種於稀釋後的酒精溶液並保持一定溫度,放置於一個通風的位置,在幾個月內就能夠變為醋。工業生產醋的方法通過提供氧氣使得此過程加快。
現在商業化生產所用方法其中之一被稱為「快速方法」或「德國方法」,因為首次成功是在1823年的德國。此方法中,發酵是在一個塞滿了木屑或木炭的塔中進行。含有酒精的原料從塔的上方滴入,新鮮空氣從他的下方自然進入或強制對流。改進後的空氣供應使得此過程能夠在幾個星期內完成,大大縮短了制醋的時間。
現在的大部分醋是通過液態的細菌培養基製備的,由Otto Hromatka和Heinrich Ebner在1949年首次提出。在此方法中,酒精在持續的攪拌中發酵為乙酸,空氣通過氣泡的形式被充入溶液。通過這個方法,含乙酸15%的醋能夠在兩至三天製備完成。
無氧發酵
編輯部分厭氧細菌,包括梭菌屬的部分成員,能夠將糖類直接轉化為乙酸而不需要乙醇作為中間體。總體反應方程式如下:
- C6H12O6 → 3CH3COOH
更令工業化學感興趣的是,許多細菌能夠從僅含單碳的化合物中生產乙酸,例如甲醇,一氧化碳或二氧化碳與氫氣的混合物。
梭菌屬因為有能夠直接使用糖類的能力,減少了成本,這意味着這些細菌有比醋菌屬細菌的乙醇氧化法生產乙酸更有效率的潛力。然而,梭菌屬細菌的耐酸性不及醋菌屬細菌。耐酸性最大的梭菌屬細菌也只能生產不到10%的乙酸,而有的醋酸菌能夠生產20%的乙酸。到現在為止,使用醋酸屬細菌制醋仍然比使用梭菌屬細菌製備後濃縮更經濟。所以,儘管梭菌屬的細菌早在1940年就已經被發現,但它的工業應用仍然被限制在一個狹小的範圍。
甲醇羰基化法
編輯大部分乙酸是通過甲醇羰基化合成的。此反應中,甲醇和一氧化碳反應生成乙酸,方程式如下
這個過程是以碘代甲烷為中間體,分三個步驟完成,並且需要一個一般由多種金屬構成的催化劑(第二步中)
- (2) CH3I + CO → CH3COI
- (3) CH3COI + H2O → CH3COOH + HI
通過控制反應條件,也可以通過同樣的反應生成乙酸酐。因為一氧化碳和甲醇均是常用的化工原料,所以甲基羰基化一直以來備受青睞。早在1925年,英國塞拉尼斯公司的Henry Drefyus已經開發出第一個甲基羰基化制乙酸的試點裝置。然而,由於缺少能耐高壓(200atm或更高)和耐腐蝕的容器,此法一度受到抑制[35] 。直到1963年,德國巴斯夫化學公司用鈷作催化劑,開發出第一個適合工業生產的辦法。到了1968年,以銠為基礎的催化劑的(cis−[Rh(CO)2I2]−)被發現,使得反應所需壓力減到一個較低的水平並且幾乎沒有副產物。1970年,美國孟山都公司建造了首個使用此催化劑的設備,此後,銠催化甲基羰基化制乙酸逐漸成為支配性的孟山都法。90年代後期,英國石油成功的將Cativa催化法商業化,此法是基於銥,使用([Ir(CO)2I2]−)[36] ,它比孟山都法更加綠色也有更高的效率,很大程度上排擠了孟山都法。
乙醇氧化法
編輯
可用高錳酸鉀、重鉻酸鉀等氧化。
乙醛氧化法
編輯在孟山都法商業生產之前,大部分的乙酸是由乙醛氧化製得。儘管不能與甲基羰基化相比,此法仍然是第二種工業制乙酸的方法。乙醛可以通過氧化丁烷或輕石腦油製得,也可以通過乙炔水合後生成。當丁烷或輕石腦油在空氣中加熱,並有多種金屬離子包括鎂,鈷,鉻以及過氧根離子催化,會分解出乙酸。化學方程式如下:
此反應可以在能使丁烷保持液態的最高溫度和壓力下進行,一般的反應條件是150℃和55 atm。副產物包括丁酮,乙酸乙酯,甲酸和丙酸。因為部分副產物也有經濟價值,所以可以調整反應條件使得副產物更多的生成,不過分離乙酸和副產物使得反應的成本增加。
在類似條件下,使用上述催化劑,乙醛能被空氣中的氧氣氧化生成乙酸
使用新式催化劑,此反應能獲得95%以上的乙酸產率。主要的副產物為乙酸乙酯,甲酸和甲醛。因為副產物的沸點都比乙酸低,所以很容易通過蒸餾除去。
乙烯氧化法
編輯由乙烯在催化劑(所用催化劑為氯化鈀:PdCl2、氯化銅:CuCl2和乙酸錳:(CH3COO)2Mn)存在的條件下,與氧氣發生反應生成。此反應可以看作先將乙炔氧化成乙醛,再通過乙醛氧化法製得。
丁烷氧化法
編輯丁烷氧化法又稱為直接氧化法,這是用丁烷為主要原料,通過空氣氧化而製得乙酸的一種方法,也是主要的乙酸合成方法。
2CH3CH2CH2CH3 + 5O2 4CH3COOH + 2H2O
其他方法
編輯除上述方法之外,還有許多製取乙酸的方法和途徑。
例如:甲烷和一氧化碳或二氧化碳在催化作用下生成乙酸[37]
用途
編輯乙酸是製備很多化合物所需要使用的基本化學試劑。最大的單一使用乙酸的是製備乙酸乙烯酯單體,接下來是製備乙酸酐和其他酯。在醋中的乙酸僅佔了所有乙酸中的很小一部分。
乙酸乙烯酯單體
編輯乙酸的最主要用途是製備乙酸乙烯酯單體,消耗了大概40%到45%的世界乙酸產量。這個反應是通過乙烯和乙酸在鈀催化下與氧氣反應。
- 2 CH3COOH + 2 C2H4 + O2 → 2 CH3COOC=CH2 + 2 H2O
乙酸乙烯酯可以聚合形成聚乙酸乙烯酯或其他聚合物,這些聚合物被使用於顏料及粘合劑。
乙酸酐
編輯兩分子乙酸的縮合產物是乙酸酐,每年全世界生產乙酸酐消耗了大概25%-30%的乙酸。乙酸酐也可以直接通過甲醇羰基化製備。Cativa的設備也可以用來生產乙酸酐。
乙酸酐是一個很強的乙酰化試劑。因此,它的主要用途就是制乙酸纖維素酯,這個合成織物主要用於製作電影膠片。乙酸酐也用來製備阿士匹靈和海洛英等其他化合物。
醋
編輯以醋的形式,乙酸溶液(一般含5%到18%(質量分數)的乙酸)被用作調味品,也被用來醃蔬菜和其他食物。一般來說,醃菜用的醋在濃度上比一般調味品醋濃度更大。食用醋的總量在世界乙酸年產量中只佔一個很小的比例,不過在歷史上,這卻是一個悠久的應用。
醋的製作方法分為2種: 1.釀造法 最傳統的方法,以酒精發酵製成。 2.化學合成法 以冰醋酸稀釋後,加入香料調味而成。此方法成本低廉,但風味較差,也容易為不良商人使用。
溶劑
編輯冰醋酸是一個良好的極性質子溶劑,常常被用來作為重結晶提純有機化合物的溶劑。純的溶融狀態的乙酸是生產對苯二甲酸的溶液,對苯二甲酸是製備聚對苯二甲酸乙二酯的重要原料。儘管現在僅有5%-10%的乙酸作此用途,不過據預測,它在今後幾十年內將有顯著的增長,因為聚對苯二甲酸乙二酯的產量正在增加。
在有碳正離子參與的反應中,常常使用乙酸作為溶液,例如傅-克反應。
冰醋酸在分析化學上被用來與弱鹼反應,比如有機氨基化合物。冰醋酸比水的酸性更強而鹼性更弱,因此氨基化合物在中間過程中類似於強鹼,可以被溶於乙酸中的強酸滴定,比如溶於乙酸的高氯酸;而在水中為強酸的氫鹵酸在冰醋酸中只能部分電離,從而體現出其酸性的差別。
其他應用
編輯稀釋的醋酸溶液因為它溫和的酸性也常常被用來作為一種除鏽的試劑。它的酸性也被用來治療被立方水母綱水母刺傷,如果使用及時,可以通過使水母的刺細胞失去效果達到防止嚴重受傷甚至死亡的效果。也可以用來為使用Vosol治療外耳炎做準備。同樣,乙酸也被用來做成噴射防腐劑,抑制細菌和真菌的生長。
幾種用乙酸製備的有機或無機鹽:
乙酸的取代產物:
安全性
編輯濃度較高的乙酸具有腐蝕性。濃度超過50%的乙酸足以灼傷未破損的皮膚。這種灼傷是慢性的,當皮膚暴露於濃乙酸時,起初不會有任何感覺;如未能及時處理,在0.5到4小時之後暴露部位會起水泡,並產生劇烈持續的疼痛感;此時即使用清水或碳酸氫鈉溶液沖洗亦無濟於事。濃乙酸亦能對眼、口、鼻等部位的黏膜組織造成不可逆的永久損傷。[6]不同濃度的乙酸溶液的歐盟分級[38]如下表所示:
| 濃度 |
莫耳濃度 | 分級 | R-Phrases |
|---|---|---|---|
| 10%–25% | 1.67–4.16 mol/L | 刺激 (Xi) | R36/38 |
| 25%–90% | 4.16–14.99 mol/L | 腐蝕 (C) | R34 |
| >90% | >14.99 mol/L | 腐蝕 (C) | R10, R35 |
此外,乙酸蒸汽對呼吸道和眼部也具有強烈的刺激性。研究結果顯示,在封閉場所中,濃度低至10ppm的乙酸蒸汽就足以對人體造成累積傷害。因此,操作乙酸時需採取適當的防護措施:貯存乙酸的容器須保持密閉;場所需保持良好通風;必要時可穿戴防毒面具、護目鏡、防水手套、鞋靴等裝備。如吸入過量乙酸蒸汽,則應立即撤離至安全場所;如皮膚、眼睛等部位接觸到了乙酸,則應立即以足量清水沖洗暴露部位;如不慎吞服,則可飲用清水稀釋之,切勿催吐。以上情況下,傷者均應及時就醫。[6][18]
乙酸的閃點為43℃(開杯)/39℃(閉杯),爆炸極限約4%~16%(體積比),自燃點約520℃,介於「可燃」與「易燃」之間。純乙酸受熱可自燃,遇明火可點燃。乙酸的可燃性隨含水量的增加而急劇下降,濃度低於56%即不燃。[6][18]
參見
編輯- 用途
- 化學
- 相關化合物
參考文獻
編輯- ^ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4 (頁面存檔備份,存於互聯網檔案館)
- ^ Armarego, W.L.F.; Chai, Christina. Purification of Laboratory Chemicals, 6th edition. Butterworth-Heinemann. 2009. ISBN 978-1-85617-567-8.
- ^ Cooper, Caroline. Organic Chemist's Desk Reference 2. CRC Press. 9 August 2010: 102–104. ISBN 978-1-4398-1166-5.
- ^ DeSousa, Luís R. Common Medical Abbreviations. Cengage Learning. 1995: 97. ISBN 978-0-8273-6643-5.
- ^ 歷史月刊 (60–65): 3. 1993.
- ^ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 6.10 6.11 6.12 Frank S. Wagner. John Wiley & Sons, Inc. , 編. Acetic Acid. Hoboken, NJ, USA: John Wiley & Sons, Inc. 2002-07-19 [2021-09-20]. ISBN 9780471238966. doi:10.1002/0471238961.0103052023010714.a01.pub2. (原始內容存檔於2022-03-08) (英語).
- ^ Martin, Geoffrey. Industrial and Manufacturing Chemistry Part 1, Organic. London: Crosby Lockwood. 1917: 330–331.
- ^ Adet, P. A. Mémoire sur l'acide acétique (Memoir on acetic acid). Annales de Chimie. 1798, 27: 299–319.
- ^ Thomas Thomson. A System of Chemistry 2. 1817 [2021-09-20]. (原始內容存檔於2021-09-26).
- ^ 10.0 10.1 10.2 John Hudson. The History of Chemistry. Boston, MA: Springer US. 1992 [2021-10-10]. ISBN 9781468464436. doi:10.1007/978-1-4684-6441-2 (英語).
- ^ 11.0 11.1 11.2 11.3 Alan J. Rocke. The Quiet Revolution: Hermann Kolbe and the Science of Organic Chemistry. Berkeley: UNIVERSITY OF CALIFORNIA PRESS. 1993 [2021-09-27]. (原始內容存檔於2021-09-27).
- ^ 12.0 12.1 Edgar Heilbronner, Foil A. Miller. A Philatelic Ramble Through Chemistry. John Wiley &Sons. 2004: 63 [2021-09-20]. (原始內容存檔於2021-09-26).
- ^ Aaron J. Ihde. The Development of Modern Chemistry. Courier Corporation. 1984: 218 [2021-09-20]. (原始內容存檔於2021-09-21).
- ^ 14.0 14.1 Edward Frankland. Frankland and Kolbe. London: Macmillan Education UK. 1964: 500–532 [2021-09-20]. ISBN 9781349005567. doi:10.1007/978-1-349-00554-3_16 (英語).
- ^ Benfey, O. Theodor. From vital force to structural formulas. Beckman Center for the History of Chemistry. 1992. ISBN 9780841202733.
- ^ Martin, Geoffrey. Part 1, Organic. Industrial and Manufacturing Chemistry. London: Crosby Lockwood. 1917: 330–31.
- ^ Schweppe, Helmut. Identification of dyes on old textiles. J. Am. Inst. Conservation. 1979, 19 (1/3): 14–23 [2006-10-21]. (原始內容存檔於2009-05-29).
- ^ 18.0 18.1 18.2 18.3 Victor H. Agreda (編). Acetic Acid and its Derivatives 0. CRC Press. 1992-12-16 [2021-10-11]. ISBN 9780429179327. doi:10.1201/9781482277272 (英語).
- ^ 19.0 19.1 19.2 19.3 19.4 A Textbook of Organic Chemistry. S CHAND & Company Limited. 2017. ISBN 9789352531967 (英語).
- ^ 20.0 20.1 R. E. Jones, D. H. Templeton. The crystal structure of acetic acid. Acta Crystallographica. 1958-07-10, 11 (7): 484–487 [2021-10-18]. doi:10.1107/S0365110X58001341. (原始內容存檔於2021-10-19).
- ^ James B. Togeas. Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments. The Journal of Physical Chemistry A. 2005-06-01, 109 (24): 5438–5444 [2021-10-18]. ISSN 1089-5639. doi:10.1021/jp058004j. (原始內容存檔於2021-10-20) (英語).
- ^ Ondřej Socha, Martin Dračínský. Dimerization of Acetic Acid in the Gas Phase—NMR Experiments and Quantum-Chemical Calculations. Molecules. 2020-05-04, 25 (9): 2150 [2021-10-18]. ISSN 1420-3049. PMC 7248931 . PMID 32375390. doi:10.3390/molecules25092150. (原始內容存檔於2022-03-10) (英語).
- ^ John Emsley. The solution is the problem. New Scientists. 1986-02-13, 109 (1496): 34. ISSN 0262-4079 (英語).
- ^ G.S. Manku. Theoretical Principles of Inorganic Chemistry. Tata McGraw-Hill. 1980: 333. ISBN 9780070965003 (英語).
- ^ William W. Porterfield (編). Acids, Bases, and Solvents. Elsevier. 1993: 307–358 [2021-10-18]. ISBN 9780125629805. doi:10.1016/b978-0-12-562980-5.50010-5. (原始內容存檔於2018-07-02) (英語).
- ^ A. K. Covington, T. Dickinson (編). Physical Chemistry of Organic Solvent Systems. Boston, MA: Springer US. 1973 [2021-10-18]. ISBN 9781468419610. doi:10.1007/978-1-4684-1959-7 (英語).
- ^ John O.Edwards (編). Inorganic Reaction Mechanisms. Wiley. 2007: 345. ISBN 9780470166185 (英語).
- ^ Ian Morris Heilbron (編). Abadole Cytosine. Dictionary Of Organic Compounds 1. Oxford University Press. 1952: 6 (英語).
- ^ Steven S. Zumdahl, Donald J. DeCoste. Introductory Chemistry: A Foundation 9. Cengage Learning. 2018-01-01. ISBN 978-1337399425 (英語).
- ^ 薛超友, 邱凌, 郭俏, 薛泉宏. 沼液中乙酸含量比色测定法研究. 農業資源與環境學報. 2018, 35 (5): 476-482 (中文).
- ^ The International Pharmacopoeia. WHO: 26. 2006 (英語).
- ^ Yoneda, Noriyki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). Appl. Catal. A: Gen. 221, 253–265.
- ^ "Production report". Chem. Eng. News (July 11, 2005), 67–76.
- ^ Suresh, Bala (2003). "Acetic Acid" (頁面存檔備份,存於互聯網檔案館). CEH Report 602.5000, SRI International.
- ^ Wagner, Frank S. (1978) "Acetic acid." In: Grayson, Martin (Ed.) Kirk-Othmer Encyclopedia of Chemical Technology, 3rd edition, New York: John Wiley & Sons.
- ^ Lancaster, Mike (2002) Green Chemistry, an Introductory Text, Cambridge: Royal Society of Chemistry, pp. 262–266. ISBN 978-0-85404-620-1.
- ^ 王曉紅(2002). 「CH4 CO2低溫轉化合成含氧有機物的研究」 17-18 太原理工大學(2002年5月)
- ^ C&L Inventory. echa.europa.eu. [2023-07-18]. (原始內容存檔於2021-04-13).
外部連結
編輯- 揚子石化
- 化工世界-乙酸頁面
- 乙酸(頁面存檔備份,存於互聯網檔案館)
- (英文)CID 176 PubChem的連結
- (英文)計算化學維基
- (英文)物質安全數據
- (英文)美國國家污染物質列表-乙酸現狀
- (英文)國立職業安全與健康研究所化學品危害手冊(頁面存檔備份,存於互聯網檔案館)
- (英文)29 CFR 1910.1000, Table Z-1(頁面存檔備份,存於互聯網檔案館)(美國允許暴露極限值)
- (英文)美國國家防火協會職業訓練表
- (英文)塞拉尼斯官方網站(頁面存檔備份,存於互聯網檔案館)
- (英文)乙酸的用法 有機合成
- (英文)乙酸的pH和滴定 - 數據分析,模擬及生成圖表的免費軟件(頁面存檔備份,存於互聯網檔案館)
- (英文)ChemSub Online: CAS號 64-19-7, 乙酸(頁面存檔備份,存於互聯網檔案館)