布加综合征
布加综合征(Budd-Chiari syndrome,BCS),根据翻译不同也被称为巴德-吉亚利综合征[1],是由于各种原因引起的肝静脉和/或其开口上段下腔静脉部分或完全梗阻性病变引起的肝静脉—下腔静脉血液回流障碍,导致以淤血性门静脉高压症和下腔静脉高压症为特点的一系列综合征[2]。主要临床表现为腹痛、肝脾肿大、腹水以及下肢水肿等。布加综合征的表现多样,可以是暴发性、急性、慢性或者没有症状。发病率较低,比较罕见,每一百万人有一人发病[3],女性比男性多见,常见于30~40岁的人,儿童和老年人少见[4]。其中约10%-20%伴有门静脉阻塞。
| 布加综合征 | |
|---|---|
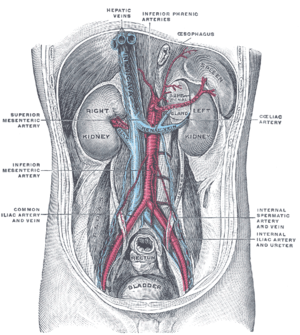 | |
| 去除腹膜后的后腹壁,显示肾、肾上腺胶囊和大血管。肝静脉位于中间靠上处。 (《格雷氏解剖学》) | |
| 类型 | hepatic vascular disease[*]、经济机舱综合征、疾病 |
| 分类和外部资源 | |
| 医学专科 | 肝脏病学 |
| ICD-11 | DB98.5 |
| ICD-10 | I82.0 |
| ICD-9-CM | 453.0 |
| OMIM | 600880 |
| DiseasesDB | 1735 |
| MedlinePlus | [1] |
| eMedicine | med/2694 ped/296 radio/121 |
| MeSH | D006502 |
| Orphanet | 131 |
历史
编辑1845年,英国内科医生George Budd在其著作《On Disease of the Liver》第一次描述了2例因肝静脉内膜炎所致肝静脉血栓的病例[5]。1898年,奥地利病理学家Hans Chiari在此基础上有研究了13例类似症状病人的病例,总结了肝静脉血栓形成临床表现,第一次描述了其病理学改变,并且发现这些病例的共同特点是由于感染引起肝静脉内膜炎后导致肝静脉血栓形成[6][7]。之后陆续又有类似特征的病例报道,但其命名尚不统一,直到1946年,《新英格兰医学杂志》首次以上述两人的姓氏Budd-Chiari来命名这种综合征并沿用至今[8]。
症状和体征
编辑布加综合征的主要临床表现为腹痛、腹水和肝脾肿大三联征[9][10]。依据血管受累的数量和程度以及阻塞病变的性质和状态等而殊不相同,布加综合征可分为暴发型、急性型、亚急性型和慢性型:
病因
编辑布加综合征的病因复杂,尚未完全明确。约有一半的患者未能找到明确的病因。根据病因布加综合征可分为原发性布加综合征和继发性布加综合征。其中原发性布加综合征约占75%,在东亚主要是由于静脉膜性梗阻引起,而在西方国家大部分是由肝静脉/下腔静脉内血栓形成引起[11];继发性布加综合征约占25%,由肝静脉外的占位性病变(如肝肿瘤)压迫血管引起,感染(如结核)、先天性静脉网形成、下腔静脉狭窄和中毒等也可继发引起布加综合征。
肝静脉血栓形成和下面因素有关(按发生率排列):1、真性红细胞增多症;2、妊娠;3、产后;4、使用口服避孕药;5、阵发性睡眠性血红蛋白尿;6、肝细胞癌。病人一般都已知有血栓形成的危险,如存在蛋白C缺乏、蛋白S缺乏、凝血因子V Leiden突变、凝血酶原G20210A基因突变的遗传倾向[12]。和基因无关的最重要危险因素是服用含有雌激素的避孕药,其他危险因素还包括抗磷脂综合征,曲霉病,白塞氏病,服用达卡巴嗪,怀孕以及创伤。很多布加综合征患者同时存在真性红细胞增多症(血红细胞的骨髓增殖性疾病)[13]。患有阵发性睡眠性血红蛋白尿的患者出现布加综合征的风险超过其他形式:其中高达39%的患者有静脉血栓形成[14],12%可能出现布加综合征[15]。由含有吡咯生物碱的植物及草药如琉璃苣、贯叶泽兰、款冬花、涂圣志、紫草、向日葵(葵花子)和石蚕等也可能引起中毒性静脉闭塞性疾病从而出现布加综合征。
特别的,在接受骨髓移植后使用药物经常会发生静脉闭塞的并发症,虽然其作用机制和表现与布加综合征相似,但不被视为布加综合征的病因。
病理生理学
编辑从肝小叶下静脉以上至右心房入口处以下的肝静脉和/或肝段下腔静脉范围内任何性质的阻塞,都属于布加综合征。静脉阻塞导致血液回流受阻停滞,进而使肝窦和门脉系统压力增加。门脉高压可以导致:1、血管内外静脉压和渗透压之间的平衡破坏,血液中的液体溢入腹腔形成腹水;2、可在远端食管、胃底和直肠出现门体侧支循环,以减轻门脉高压,从而使得远端食管、胃底和直肠出现静脉曲张。
静脉阻塞也可导致肝细胞因为缺血小叶中心坏死及周边小叶脂肪变性。如果这些情况长期存在,将会出现槟榔肝,即肝小叶中央区因严重淤血呈暗红色,而周边小叶肝细胞则因脂肪变性呈黄色,致使肝脏形成类似槟榔切面的条纹,肝质地变硬,导致淤血性肝硬化。而肾素-血管紧张素途径的激活和过量的钠潴留可能导致肾功能衰竭的出现。
分型
编辑根据疾病的病变部位可以分为三型[1]:
诊断
编辑当怀疑患者有布加综合征时,应该抽血检测肝转氨酶水平以及其他器官标记物(如肌酐、尿素、电解质、乳酸脱氢酶)。
腹部超声检查和血管逆行造影是诊断布加综合征最常用的方法。超声检查可显示肝静脉血栓形成或狭窄、蜘蛛网状血管、大的侧支血管或取代了正常静脉的强回声线。虽然计算机断层扫描(CT)或磁共振成像(MRI)一般对诊断布加综合征不敏感,但有时也可以使用。肝活检是非特异性的,单纯活检无法对布加综合征进行确诊,但有时可以用来对布加综合征和其他可引起肝肿大、腹水的疾病如半乳糖血症或瑞氏综合征的鉴别诊断。
治疗
编辑少数患者可以通过药物辅以一般的对症治疗,如通过限制钠摄入量和利尿剂来控制腹水,使用肝素和华法林等抗凝血剂消凝等。大部分患者则需要进一步的治疗。症状比较轻微的布加综合征患者,可以采用手术放置分流器的方式疏导血液流向肝脏周围的阻塞部分或肝脏本身。手术在病情诊断明确后早期完成效果最佳[16]。经颈静脉肝内门体分流术(TIPS)也有类似的作用,但这种方法手术过程的死亡率低,因此现在越来越经常使用。静脉血管狭窄或栓塞的病人也可以行血管成形术[17]。少数研究表明,直接向阻塞静脉输注尿激酶和组织型纤溶酶原激活物(tPA)进行溶栓治疗在一定程度上也有助于布加综合征患者的治疗,但这并非常规的治疗方法。
肝移植是治疗布加综合征的有效方法。这种方法一般只对发生暴发性肝衰竭、手术分流失败或发展为肝硬化,期望寿命减低为1年的患者施行[18]。这种方法的长期生存率是69%-87%。肝移植最常见的并发症包括移植排斥反应、动脉或静脉血栓形成以及因抗凝导致出血。10%的患者在移植后可能复发布加综合征。
预后
编辑目前有一些研究尝试预测布加综合征患者的生存率。在一般情况下,近2/3的布加综合征患者在得病10年后依然存活[16]。影响预后效果的重要指标包括腹水,肝性脑病,Child-Pugh分级分数升高,凝血酶原时间(PT)升高,血清中各种物质(如钠,肌酐,白蛋白,胆红素)的水平改变等。生存率也和导致布加综合征的根本病因高度相关。例如,骨髓增生性疾病的患者可能发生和布加综合征无关的急性白血病而导致死亡。
参考资料
编辑- ^ 1.0 1.1 《外科学 第7版》 P533 ISBN 978-7-117-09621-8
- ^ Jaussen HL, Garcia-Pagan JC, Elias E, et al.. Budd-Chiari syndrome: a review by an expert panel. Journal of Hepatology. 2003, 38: 364–371.
- ^ Rajani R, Melin T, Björnsson E, Broomé U, Sangfelt P, Danielsson A, Gustavsson A, Grip O, Svensson H, Lööf L, Wallerstedt S, Almer SH. Budd-Chiari syndrome in Sweden: epidemiology, clinical characteristics and survival - an 18-year experience. Liver International. Feb 2009, 29 (2): 253–259 [2011-08-08]. PMID 18694401. doi:10.1111/j.1478-3231.2008.01838.x. (原始内容存档于2013-01-05).
- ^ Budd-Chiari Syndrome. [2011-08-08]. (原始内容存档于2013-12-25).
- ^ Budd G. On diseases of the liver. London: John Churchill. 1845: 135. Brit Lib. 000518193.
- ^ Chiari H. Erfahrungen über Infarktbildungen in der Leber des Menschen. Zeitschrift für Heilkunde, Prague. 1898, 19: 475–512.
- ^ Budd-Chiari Syndrome: Illustrated Review of Current Management. [2011-08-08]. (原始内容存档于2021-12-07).
- ^ Budd-Chiari syndrome - Who Named It?
- ^ Karadag O, Akinei D, Aksoy DY. Acute Budd-Chiari Syndrome Resulting from a Pyogenic Liver Abscess. Hepatogastroen-terology. 2005, 52 (7): 1554–1613.
- ^ Buckley O,O'Brien Snow J. Imaging of Budd-Chiari Syndrome. Eur Radiology. 2007, 17 (6): 2071–2078.
- ^ Us kudar 0, Akdogan M, Sasmaz N. Etiology and Portal Vein Thrombosis in Budd-Chiari Syndrome. World J Gastroenterol. 2008, 14 (18): 2858–2862.
- ^ Podnos YD, Cooke J, Ginther G, Ping J, Chapman D, Newman RS, Imagawa DK. Prothrombin Mutation G20210A as a Cause of Budd-Chiari Syndrome (PDF). Hospital Physician. Aug 2003, 39 (8): 41–4 [2011-08-08]. (原始内容 (PDF)存档于2012-02-18).
- ^ Patel RK, Lea NC, Heneghan MA; et al. Prevalence of the activating JAK2 tyrosine kinase mutation V617F in the Budd-Chiari syndrome. Gastroenterology. Jun 2006, 130 (7): 2031–8. PMID 16762626. doi:10.1053/j.gastro.2006.04.008.
- ^ Hillmen P, Lewis SM, Bessler M, Luzzatto L, Dacie JV. Natural history of paroxysmal nocturnal hemoglobinuria. N Engl J Med. Nov 1995, 333 (19): 1253–8. PMID 7566002. doi:10.1056/NEJM199511093331904.
- ^ Socié G, Mary JY, de Gramont A; et al. Paroxysmal nocturnal haemoglobinuria: long-term follow-up and prognostic factors. French Society of Haematology. Lancet. Aug 1996, 348 (9027): 573–7 [2011-08-08]. PMID 8774569. doi:10.1016/S0140-6736(95)12360-1. (原始内容存档于2020-06-07).
- ^ 16.0 16.1 Murad SD, Valla DC, de Groen PC; et al. Determinants of survival and the effect of portosystemic shunting in patients with Budd-Chiari syndrome. Hepatology (Baltimore, Md.). Feb 2004, 39 (2): 500–8. PMID 14768004. doi:10.1002/hep.20064.
- ^ Fisher NC, McCafferty I, Dolapci M; et al. Managing Budd-Chiari syndrome: a retrospective review of percutaneous hepatic vein angioplasty and surgical shunting. Gut. Apr 1999, 44 (4): 568–74. PMC 1727471 . PMID 10075967.
- ^ Orloff MJ, Daily PO, Orloff SL, Girard B, Orloff MS. A 27-year experience with surgical treatment of Budd-Chiari syndrome. Ann Surg. Sep 2000, 232 (3): 340–52 [2011-08-08]. PMC 1421148 . PMID 10973384. doi:10.1097/00000658-200009000-00006. (原始内容存档于2013-05-31).