代謝症候群
代謝症候群(metabolic syndrome)指生理代謝層面的心血管危險因子的聚集現象,這些危險因子主要包括高血壓(或血壓偏高但未達高血壓診斷標準)、血脂異常(dyslipidemia)(包含血中三酸甘油脂偏高、高密度脂蛋白膽固醇偏低等脂質代謝異常[1])、糖尿病(或空腹血糖偏高/葡萄糖耐受不良(glucose intolerance))、肥胖(特別指中心肥胖(central obesity)或稱腹部肥胖)、以及高尿酸與凝血因子的不正常等等。
| 代謝症候群 | |
|---|---|
| 又稱 | 代謝障礙症候群 X |
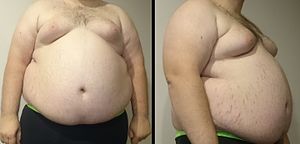 | |
| 具顯著向心性肥胖的男性,此為代謝症候群的特徵,其體重為182 kg,真高185 cm,身體質量指數(BMI)53 | |
| 症狀 | 肥胖 |
| 鑑別診斷 | 胰島素抵抗, 糖尿病前期, 高尿酸血症, 肥胖, 非酒精性脂肪性肝病, 多囊卵巢症候群, 勃起功能障礙, 黑棘皮病 |
| 分類和外部資源 | |
| 醫學專科 | 內分泌學 |
| ICD-11 | 5A44 |
| ICD-9-CM | 277.7 |
| OMIM | 605552 |
| DiseasesDB | 31955 |
| MedlinePlus | 007290 |
| eMedicine | 165124 |
歷史
編輯- 在1920年左右瑞典醫師Kylin發現高血壓、高血糖及痛風常出現在同一病人身上。
- 1947年Vague發現上半身的肥胖常與糖尿病及心血管疾病相關。
- 1988年Reaven提出Syndrome X 的概念,並認為與胰島素抵抗有密切相關。
定義
編輯代謝症候群的定義曾經多次改動,目前仍在使用的定義也有好幾種,其差異可能來自對於代謝症候群的切入點的不同所致。影響力較大的幾種定義如下:
1998 世界衛生組織(WHO)定義
編輯世界衛生組織對於代謝症候群的定義自從糖尿病的面向出發。其定義標準為,在糖尿病或空腹血糖偏高或葡萄糖耐受不良或胰島素抗性(整個族群當中,進行euglycemic hyperinsulinemic clamp結果最不佳的四分之一)的狀態,合併有以下情況二者及以上者,即為代謝症候群:
- 肥胖(男性腰圍除以臀圍比率大於0.9、女性大於0.85),或身體質量指數在30以上者。
- 脂質代謝異常:三酸甘油脂大於等於150毫克/公合或高密度脂蛋白膽固醇過低(男性低於35毫克/公合、女性低於39毫克/公合)。
- 血壓大於130/85毫米汞柱。
- 微白蛋白尿(microalbuminuria),指白蛋白的尿液排除率(excretion rate)大於20μg/min。
2001 美國NBA膽固醇教育計畫NCEP ATP III定義
編輯全稱為The Third Report of the National Cholesterol Education Program Expert Panel(NCEP) on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III)。此代謝症候群的定義是,滿足下列症狀標準(含)三項以上者,即為代謝症候群:
- 男性腰圍大於90公分、女性大於80公分。
- 三酸甘油脂大於150毫克/公合。
- 男性高密度脂蛋白膽固醇低於40毫克/公合、女性低於50毫克/公合。
- 血壓大於等於130/85毫米汞柱。
- 空腹血糖大於等於100毫克/公合。
其中腹圍大小的標準在不同種族間存在著明顯差異,因此在亞洲地區的研究者也提出不同的肥胖定義,即男性腰圍大於90公分、女性大於80公分。
2005 國際糖尿病聯合會(International Diabetes Federation)定義
編輯中心肥胖為必要的診斷標準,其中腰圍的標準,依各種族不同而訂有不同的標準(但很多地區/種族的腰圍標準仍未完全確定)。 亞洲地區的腰圍標準除日本的研究者建議為男≥85公分、女≥90公分外,南亞及台灣均為男≥90公分,女≥80公分。 具有中廣型肥胖(腰圍過大),再加上以下標準其中兩種以上者,即被定義為有代謝症候群:
- 三酸甘油脂大於150毫克/公合。
- 男性高密度脂蛋白膽固醇低於40毫克/公合、女性低於50毫克/公合。
- 血壓大於等於130/85毫米汞柱。
- 空腹血糖大於等於100毫克/公合。
2009 國際學會聯合聲明
編輯在2009年,國際糖尿病聯合會、美國心肺血研究所(National Heart, Lung, and Blood Institute)、美國心臟學會(American Heart (International Diabetes Federation)定義中依照族裔別不同而調整的腰圍標準,來診斷代謝症候群。[2]
原因
編輯代謝症候群複雜途徑的機制正在進行研究。病理生理學非常複雜,目前只有部分闡明。受該病症影響的大多數人年齡較大,肥胖,久坐不動,且存在一定程度的胰島素抵抗。壓力也可能是一個促發因素。最重要的風險因素包括飲食(尤其是含糖飲料的攝入),[3] 遺傳學,[4][5][6][7] 老化,久坐不動[8] 或低體力活動,[9][10] 破壞的晝夜生物學/睡眠,[11] 心情障礙/精神藥物使用,[12][13] 以及過度飲酒。[14] Vidal-Puig回顧了過度暴飲暴食引起的脂肪組織過度擴張以及由此產生的脂毒性在症候群中的致病作用。[15]
關於肥胖還是胰島素抵抗是否是代謝症候群的原因,或者它們是否是更深層代謝紊亂的後果,存在爭議。系統性發炎標誌物,包括C-反應蛋白,通常升高,纖維蛋白原、白血球介素6、腫瘤壞死因子-α(TNF-α)等也升高。一些人指出了多種原因,包括由飲食果糖引起的尿酸水平升高。[16][17][18][19]
研究表明,西方飲食習慣是代謝症候群發展的因素,其中高消耗不適合人類生化的食物。[20][頁碼請求] 體重增加與代謝症候群有關。與總脂肪含量不同,該症候群的核心臨床組分是內臟和/或異位脂肪(即不適合儲存脂肪的器官中的脂肪),而主要的代謝異常是胰島素抵抗。[21] 持續提供通過飲食碳水化合物,脂肪和蛋白質燃料,與體力活動/能量需求不匹配,會導致氧化磷酸化產物的積壓,這是與進行性粒線體功能障礙和胰島素抵抗相關的過程。[22]
壓力
編輯最近的研究表明,長時間的慢性壓力可以通過干擾下視丘-垂體-腎上腺軸(HPA軸)的激素平衡來促進代謝症候群的發展。[23] 功能失調的HPA軸會導致高水平的皮質醇循環,導致提高葡萄糖和胰島素水平,進而在脂肪組織上引起胰島素介導的效應,最終促進內臟脂肪,胰島素抵抗,血脂異常和高血壓,直接影響骨骼,導致「低周轉」骨質疏鬆症。[24] HPA軸功能失調可能解釋了腹部肥胖與心血管疾病(CVD),第2型糖尿病和中風的風險關聯。[25] 心理社會壓力也與心臟病相關。[26]
肥胖
編輯中心性肥胖是該症候群的關鍵特徵,既是一種標誌,又是一種原因,因為在高腰圍反映出來的肥胖增加往往可能既是胰島素抵抗的結果,也可能是胰島素抵抗的促成因素。然而,儘管肥胖很重要,但體重正常的受影響人群也可能存在胰島素抵抗並患有該症候群。[27]
久坐不動的生活方式
編輯缺乏體力活動是心血管疾病事件和相關死亡的預測因素。代謝症候群的許多組分與久坐不動的生活方式相關,包括增加的脂肪組織(主要是中心性的);降低的高密度脂蛋白膽固醇;以及在遺傳易感性方面趨於增加的三酸甘油酯、血壓和葡萄糖水平。與每天看電視或視頻或使用電腦不到一小時的人相比,每天進行這些活動超過四小時的人患代謝症候群的風險增加了一倍。[27]
老化
編輯代謝症候群影響了60%的美國50歲以上的人口。在這個人口統計中,患該症候群的女性比例高於男性。症候群的患病率隨年齡增長,在世界上大多數人群中都有這種趨勢。[27]
臨床意義
編輯有代謝症候群的人,其罹患心血管疾病、腦血管疾病及腎臟疾病的危險比沒有代謝症候群的人高,因此代謝症候群的預防與治療,目前是臨床醫學及基礎研究引起極大關注的主題。
爭議
編輯2005年是代謝症候群研究社群中最熱鬧的一年。除了該年出現了國際糖尿病聯合會所提出的新定義,讓全球研究者開始評估兩套定義的價值。與此同時,美國糖尿病學會與歐洲糖尿病研究學會的學者,其發表的聯合聲明提出八個對代謝症候群的臨床價值的提問。在歐美糖尿病學會提出的對代謝症候群的省思之外,被譽為代謝症候群研究先驅的Gerald Reaven也發表文章認為代謝症候群診斷是一種多餘的診斷。 [28][29][30]
這些來自專業的不同聲音,並非否認代謝異常會聚集的現象。他們所懷疑的是代謝症候群所帶來的風險高於單項風險的加總此一觀點。
參看
編輯參考資料
編輯- ^ 脂肪轉化重要樞紐~肝臟的脂質代謝功能. [2014-07-09]. (原始內容存檔於2014-07-11).
- ^ Alberti KG, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, Fruchart JC,James WP, Loria CM, Smith SC Jr; International Diabetes Federation Task Force on Epidemiology and Prevention; Hational Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; International Association for the Study of Obesity. Circulation 2009;120(16):1640-5. PMID 19805654.
- ^ Malik VS, Popkin BM, Bray GA, Després JP, Willett WC, Hu FB. Sugar-sweetened beverages and risk of metabolic syndrome and type 2 diabetes: a meta-analysis. Diabetes Care. November 2010, 33 (11): 2477–83. PMC 2963518 . PMID 20693348. doi:10.2337/dc10-1079.
- ^ Pollex RL, Hegele RA. Genetic determinants of the metabolic syndrome. Nature Clinical Practice Cardiovascular Medicine. September 2006, 3 (9): 482–89. PMID 16932765. S2CID 24558150. doi:10.1038/ncpcardio0638.
- ^ Poulsen P, Vaag A, Kyvik K, Beck-Nielsen H. Genetic versus environmental aetiology of the metabolic syndrome among male and female twins. Diabetologia. May 2001, 44 (5): 537–43. PMID 11380071. S2CID 26582450. doi:10.1007/s001250051659 .
- ^ Groop L. Genetics of the metabolic syndrome. The British Journal of Nutrition. March 2000, 83 (Suppl 1): S39–S48. PMID 10889791. S2CID 8974554. doi:10.1017/S0007114500000945 .
- ^ Bouchard C. Genetics and the metabolic syndrome. International Journal of Obesity and Related Metabolic Disorders. May 1995, 19 (Suppl 1): S52–59. PMID 7550538.
- ^ Edwardson CL, Gorely T, Davies MJ, Gray LJ, Khunti K, Wilmot EG, Yates T, Biddle SJ. Association of sedentary behaviour with metabolic syndrome: a meta-analysis. PLOS ONE. 2012, 7 (4): e34916. Bibcode:2012PLoSO...734916E. PMC 3325927 . PMID 22514690. doi:10.1371/journal.pone.0034916 .
- ^ Katzmarzyk PT, Leon AS, Wilmore JH, Skinner JS, Rao DC, Rankinen T, Bouchard C. Targeting the metabolic syndrome with exercise: evidence from the HERITAGE Family Study. Medicine and Science in Sports and Exercise. October 2003, 35 (10): 1703–09. PMID 14523308. S2CID 25598917. doi:10.1249/01.MSS.0000089337.73244.9B.
- ^ He D, Xi B, Xue J, Huai P, Zhang M, Li J. Association between leisure time physical activity and metabolic syndrome: a meta-analysis of prospective cohort studies. Endocrine. June 2014, 46 (2): 231–40. PMID 24287790. S2CID 5271746. doi:10.1007/s12020-013-0110-0.
- ^ Xi B, He D, Zhang M, Xue J, Zhou D. Short sleep duration predicts risk of metabolic syndrome: a systematic review and meta-analysis. Sleep Medicine Reviews. August 2014, 18 (4): 293–97. PMID 23890470. doi:10.1016/j.smrv.2013.06.001.
- ^ Vancampfort D, Correll CU, Wampers M, Sienaert P, Mitchell AJ, De Herdt A, Probst M, Scheewe TW, De Hert M. Metabolic syndrome and metabolic abnormalities in patients with major depressive disorder: a meta-analysis of prevalences and moderating variables. Psychological Medicine. July 2014, 44 (10): 2017–28 [2023-08-09]. PMID 24262678. S2CID 206253750. doi:10.1017/S0033291713002778. (原始內容存檔於2016-03-26).
- ^ Vancampfort D, Vansteelandt K, Correll CU, Mitchell AJ, De Herdt A, Sienaert P, Probst M, De Hert M. Metabolic syndrome and metabolic abnormalities in bipolar disorder: a meta-analysis of prevalence rates and moderators. The American Journal of Psychiatry. March 2013, 170 (3): 265–74. PMID 23361837. doi:10.1176/appi.ajp.2012.12050620.
- ^ Sun K, Ren M, Liu D, Wang C, Yang C, Yan L. Alcohol consumption and risk of metabolic syndrome: a meta-analysis of prospective studies. Clinical Nutrition. August 2014, 33 (4): 596–602. PMID 24315622. doi:10.1016/j.clnu.2013.10.003.
- ^ Vidal-Puig A. Adipose tissue expandability, lipotoxicity and the metabolic syndrome. Endocrinologia y Nutricion. 2013, 60 (Suppl 1): 39–43. PMID 24490226. doi:10.1016/s1575-0922(13)70026-3.
- ^ Nakagawa T, Hu H, Zharikov S, Tuttle KR, Short RA, Glushakova O, Ouyang X, Feig DI, Block ER, Herrera-Acosta J, Patel JM, Johnson RJ. A causal role for uric acid in fructose-induced metabolic syndrome. American Journal of Physiology. Renal Physiology. March 2006, 290 (3): F625–31. PMID 16234313. doi:10.1152/ajprenal.00140.2005.
- ^ Hallfrisch J. Metabolic effects of dietary fructose. FASEB Journal. June 1990, 4 (9): 2652–60. PMID 2189777. S2CID 23659634. doi:10.1096/fasebj.4.9.2189777.
- ^ Lakka TA, Laaksonen DE. hút mỡ bụng. Applied Physiology, Nutrition, and Metabolism. February 2007, 32 (1): 76–88 [2023-08-09]. PMID 17332786. doi:10.1139/h06-113. (原始內容存檔於2023-05-11).
- ^ Reiser S, Powell AS, Scholfield DJ, Panda P, Ellwood KC, Canary JJ. Blood lipids, lipoproteins, apoproteins, and uric acid in men fed diets containing fructose or high-amylose cornstarch. The American Journal of Clinical Nutrition. May 1989, 49 (5): 832–39. PMID 2497634. doi:10.1093/ajcn/49.5.832.
- ^ Bremer AA, Mietus-Snyder M, Lustig RH. Toward a unifying hypothesis of metabolic syndrome. Pediatrics. March 2012, 129 (3): 557–70. PMC 3289531 . PMID 22351884. doi:10.1542/peds.2011-2912.
- ^ Ali ES, Hua J, Wilson CH, Tallis GA, Zhou FH, Rychkov GY, Barritt GJ. The glucagon-like peptide-1 analogue exendin-4 reverses impaired intracellular Ca(2+) signalling in steatotic hepatocytes. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. September 2016, 1863 (9): 2135–46. PMID 27178543. doi:10.1016/j.bbamcr.2016.05.006 .
- ^ Wajchenberg BL. Subcutaneous and visceral adipose tissue: their relation to the metabolic syndrome. Endocrine Reviews. December 2000, 21 (6): 697–738. PMID 11133069. doi:10.1210/edrv.21.6.0415.
- ^ Gohil BC, Rosenblum LA, Coplan JD, Kral JG. Hypothalamic-pituitary-adrenal axis function and the metabolic syndrome X of obesity. CNS Spectrums. July 2001, 6 (7): 581–86, 589. PMID 15573024. S2CID 22734016. doi:10.1017/s1092852900002121.
- ^ Tsigos C, Chrousos GP. Hypothalamic-pituitary-adrenal axis, neuroendocrine factors and stress. Journal of Psychosomatic Research. October 2002, 53 (4): 865–71 [2023-08-09]. PMID 12377295. doi:10.1016/S0022-3999(02)00429-4. (原始內容存檔於2022-05-18).
- ^ Rosmond R, Björntorp P. The hypothalamic-pituitary-adrenal axis activity as a predictor of cardiovascular disease, type 2 diabetes and stroke. Journal of Internal Medicine. February 2000, 247 (2): 188–97. PMID 10692081. S2CID 20336259. doi:10.1046/j.1365-2796.2000.00603.x.
- ^ Brunner EJ, Hemingway H, Walker BR, Page M, Clarke P, Juneja M, Shipley MJ, Kumari M, Andrew R, Seckl JR, Papadopoulos A, Checkley S, Rumley A, Lowe GD, Stansfeld SA, Marmot MG. Adrenocortical, autonomic, and inflammatory causes of the metabolic syndrome: nested case-control study. Circulation. November 2002, 106 (21): 2659–65. PMID 12438290. S2CID 5992769. doi:10.1161/01.cir.0000038364.26310.bd .
- ^ 27.0 27.1 27.2 Fauci, Anthony S. Harrison's principles of internal medicine. McGraw-Hill Medical. 2008. ISBN 978-0-07-147692-8.[頁碼請求]
- ^ Richard Kahn. Metabolic syndrome—what is the clinical usefulness?. Lancet. 2008, 371 (9628): 1892–1893. doi:10.1016/S0140-6736(08)60731-X.
- ^ Kahn R, Buse J, Ferrannini E, Stern M. The metabolic syndrome: time for a critical appraisal. Joint statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care. 2005, 28 (9): 2289–2304. PMID 16123508. doi:10.2337/diacare.28.9.2289.
- ^ Reaven GM. The metabolic syndrome: requiescat in pace. Clin Chem 2005;51:931-8. PMID 15746300.