釓特酸
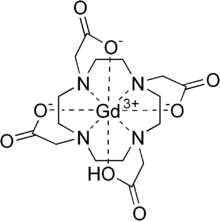
釓特酸(INN:gadoteric acid,簡寫Ga-DOTA),為釓離子(Ga3+)的大環配體DOTA形成的螯合物。在醫學上是一種釓造影劑(gadolinium-based contrast agents,GBCA),屬大環離子型造影劑,用於磁共振成像造影[2]。其動力學穩定常數,是已知穩定常數和解離半衰期最大的螯合物[3][4]。
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Artirem, Dotarem(多它靈), Clariscan等[1] |
| 其他名稱 | DOTA-Gd,Gd-DOTA, Gadoterate meglumine(釓特酸葡胺) (USAN US) |
| 給藥途徑 | 靜脈注射 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 血漿蛋白結合率 | 幾乎無 |
| 藥物代謝 | 幾乎無 |
| 生物半衰期 | 約90分鐘(血漿) 2-3分鐘(分布) |
| 排泄途徑 | 原體藥物經腎,極少部分經糞便排出 |
| 識別資訊 | |
| |
| CAS號 | 72573-82-1 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| 化學資訊 | |
| 化學式 | C16H25GdN4O8 |
| 摩爾質量 | 558.65 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
醫學上常以其葡甲胺鹽的形式,即釓特酸葡胺(USAN:Gadoterate meglumine)進行注射給藥[5][6]。
歷史
編輯釓特酸由法國加柏公司(Guerbet)研製開發,以商品名Dotarem(多它靈)於1989年獲准在法國上市,2013年3月20日通過美國FDA批准用於MRI造影[7]。
醫學用途
編輯釓特酸中心離子Ga3+具有強順磁性,可縮短磁共振(MRI)中T1弛豫時間,形成像襯度,為陽性造影劑。但高濃度下T2弛豫時間縮短占優為陰性造影劑,高濃度常用於動脈期血管造影[2]。
其被批准用於2歲以上患者的全身MRI檢查,可用於大腦、脊髓以及血管檢查。其本身無法透過血腦屏障,但大腦血管發生病變部分則可透過血腦屏障,因此可識別腦部腫瘤[8]。其以釓特酸葡胺注射液形式進行靜脈注射,藥物可在身體中存在數年[5][6]。
藥理學
編輯釓特酸和第一代MRI造影劑馬根維顯理化性能和臨床應用相似。經靜脈注射後,釓特酸先經血管擴散,然後迅速擴散細胞外空間。釓特酸通過腎臟以原體藥物排泄,少部分分泌到腸胃道經糞便排出。釓特酸非選擇性地分布在所有腦外組織的細胞外空間中,無器官特異性。釓特酸蛋白質結合力非常低因此通過腎臟相對較快地排泄。[2]
風險
編輯釓特酸作為含釓製劑,體外研究表明其具有的神經毒性,但相比於線性釓螯合物,作為大環螯合物的釓特酸相比風險更低[9][10]。在標準用量下,在大腦可檢測到藥物殘留[11]。
同時具有腎源性系統纖維化(Nephrogenic systemic fibros,NSF)風險,但目前未有相關案例報道,因此不適用於腎功能受損患者[12][13]。
合成
編輯由DOTA與氫氧化釓先在80攝氏度螯合12小時,再用氨水室溫下鹼化使pH=11即得到釓特酸Ga-DOTA。
釓特酸進一步與葡萄糖和甲胺還原胺化得到的葡甲胺1:1混合成鹽,即可得到釓特酸葡胺[14][15]。
參考文獻
編輯- ^ Gadoteric Acid International. Drugs.com. 6 January 2021 [21 January 2021]. (原始內容存檔於2019-08-17).
- ^ 2.0 2.1 2.2 2.3 何國祥; 王毅翔. 造影剂药理学及临床应用. 上海: 上海科學技術出版社. 2002. ISBN 7532362264.
- ^ P Caravan, JJ Ellison, TJ McMurry, RB Lauffer. Gadolinium (III) chelates as MRI contrast agents: structure, dynamics, and applications. Chemical Reviews. 1999, 99: 2293−2352. doi:10.1021/cr980440x.
- ^ Herborn, Christoph U. MD; Honold, Elmar MD; Wolf, Michael; Kemper, Jörn MD; Kinner, Sonja MD; Adam, Gerhard MD; Barkhausen, Jörg MD. Clinical Safety and Diagnostic Value of the Gadolinium Chelate Gadoterate Meglumine (Gd-DOTA). Investigative Radiology. 2007, 42 (1): 58–62. doi:10.1097/01.rli.0000248893.01067.e5.
- ^ 5.0 5.1 Dotarem- gadoterate meglumine injection. DailyMed. [29 August 2021]. (原始內容存檔於2024-12-06).
- ^ 6.0 6.1 Clariscan- gadoterate meglumine injection, solution. DailyMed. [29 August 2021]. (原始內容存檔於2024-12-12).
- ^ Hollmer M. Dotarem: A safe(r) gadolinium-based contrast imaging agent. FierceBiotech. 6 January 2014 [2024-06-25]. (原始內容存檔於2021-08-21).
- ^ DrugBank (編). Gadoteric acid. DrugBank. 22 August 2016 [2024-06-25]. (原始內容存檔於2019-08-17).
- ^ Bower DV, Richter JK, von Tengg-Kobligk H, Heverhagen JT, Runge VM. Gadolinium-Based MRI Contrast Agents Induce Mitochondrial Toxicity and Cell Death in Human Neurons, and Toxicity Increases With Reduced Kinetic Stability of the Agent. Investigative Radiology. August 2019, 54 (8): 453–463 [2024-06-25]. PMID 31265439. S2CID 164486744. doi:10.1097/RLI.0000000000000567. (原始內容存檔於2024-12-13).
- ^ Alexander Radbruch , Lukas D. Weberling, Pascal J. Kieslich, Oliver Eidel, Sina Burth, Philipp Kickingereder, Sabine Heiland, Wolfgang Wick, Heinz-Peter Schlemmer, Martin Bendszus. Gadolinium Retention in the Dentate Nucleus and Globus Pallidus Is Dependent on the Class of Contrast Agent. RADIOLOG. 2015, 275 (3): 783–791. doi:10.1148/radiol.2015150337.
- ^ Stanescu AL, Shaw DW, Murata N, Murata K, Rutledge JC, Maloney E, et al. Brain tissue gadolinium retention in pediatric patients after contrast-enhanced magnetic resonance exams: pathological confirmation. Pediatric Radiology. March 2020, 50 (3): 388–396. PMID 31989188. S2CID 210913930. doi:10.1007/s00247-019-04535-w.
- ^ Todd DJ, Kay J. Gadolinium-Induced Fibrosis. Annual Review of Medicine. 2016, 67: 273–91. PMID 26768242. doi:10.1146/annurev-med-063014-124936.
- ^ Csilla Balassy, Donna Roberts, Stephen F. Miller3. Safety and efficacy of gadoteric acid in pediatric magnetic resonance imaging: overview of clinical trials and post-marketing studies. Pediatr Radiol. 2015, 45: 1831–1841. doi:10.1007/s00247-015-3394-9.
- ^ S KauráLuthra, V MorissonáIveson, NE Felicity, J Nicholas. Gd 3+ cFLFLFK conjugate for MRI: a targeted contrast agent for FPR1 in inflammation. Chemical communications. 2013, 49 (6): 564–566. doi:10.1039/C2CC37460A.
- ^ 韓曉丹,郭春. 钆特酸葡甲胺. 中國藥物化學雜誌. 2013, 23 (5): 1.
