瑞替加濱
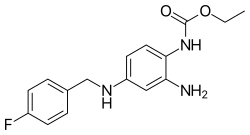
瑞替加濱(INN:Retigabine)或依佐加濱(USAN:Ezogabine)是一種由Valeant Pharmaceuticals和GlaxoSmithKline開發的抗驚厥藥,並於2011年6月10日獲得美國食品和藥物管理局(FDA)批准,商品名為Potiga ,用作有治療經驗的成年患者部分性癲癇的輔助治療。 [2] 瑞替加濱為鉀通道開放劑,即通過激活大腦中特定的電壓鉀通道家族。 [3] [4] [5]這種作用機制可以用在抗癲癇,並且可能有望用於治療其他神經系統疾病,包括耳鳴、偏頭痛和神經性疼痛。葛蘭素史克於 2017 年將瑞替加濱撤出臨床使用。 [6]
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Trobalt, Potiga |
| 其他名稱 | D-23129, ezogabine (USAN US) |
| AHFS/Drugs.com | 專業藥物信息 |
| MedlinePlus | a612028 |
| 核准狀況 | |
| 給藥途徑 | By mouth |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 60% |
| 血漿蛋白結合率 | 60–80% |
| 藥物代謝 | Liver glucuronidation and acetylation. CYP not involved |
| 生物半衰期 | 8 hours (mean), range: 7–11 hours[1] |
| 排泄途徑 | Kidney (84%) |
| 識別資訊 | |
| |
| CAS號 | 150812-12-7 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.158.123 |
| 化學資訊 | |
| 化學式 | C16H18FN3O2 |
| 摩爾質量 | 303.34 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
毒副作用
編輯嗜睡、頭暈、耳鳴和眩暈、意識混亂和言語不清 是最常見的不良反應。 [7]不太常見的副作用包括震顫、記憶喪失、步態障礙和復視。 [8]
2013年,FDA警告公眾,Potiga(ezogabine)會導致皮膚變藍和以視網膜色素變化為特徵的眼睛異常。 FDA 目前不知道這些變化是否可逆。 FDA 正在與製造商合作收集和評估所有可用信息,以更好地了解這些事件。當獲得更多信息時,FDA 將向公眾通報最新情況。 [9]精神症狀和排尿困難也有報道,大多數病例發生在治療的前兩個月。 [10] [11]
藥物相互作用
編輯瑞替加濱似乎與最常用的抗驚厥藥沒有藥物相互作用。它可能會增加拉莫三嗪(Lamictal)的代謝,而苯妥英(Dilantin)和卡馬西平(CBZ,Tegretol)會增加瑞替加濱的清除率。 [11] [13]
瑞替加濱和地高辛同時使用可能會增加後者的血清濃度。體外研究表明,瑞替加濱的主要代謝物充當P-糖蛋白抑制劑,因此可能增加地高辛的吸收並減少地高辛的消除。 [11]
藥理
編輯作用機制
編輯瑞替加濱 穩定開放的 Kv7.2/7.3 通道,而電壓依賴性幾乎沒有變化。瑞替加濱的這種作用在濃度低於 10 微摩爾時即可觀察到。 [14]在同聚 Kv7.2 通道上觀察到類似的效果。 [15]
瑞替加濱作為神經元KCNQ / Kv7鉀通道開放劑,其作用機制與任何現有抗驚厥藥明顯不同。 [3] [4] [5]這種作用機制與化學性質相似的氟吡汀[16]相似,氟吡汀主要因其鎮痛特性而被使用。
術語「離子通道開放蛋白」是指溝道開啟的電壓依賴性向更負電勢的轉變。這意味著在瑞替加濱存在的情況下,KCNQ/Kv7 通道會以更負的電位打開。
藥代動力學
編輯瑞替加濱在肝臟中通過N-葡萄糖醛酸化和乙醯化代謝。細胞色素P450系統不參與。瑞替加濱及其代謝物幾乎完全(84%)由腎臟排泄。 [11] [13]
單次口服後半小時至2小時內達到最大血漿濃度, 瑞替加濱吸收很快。它具有中等高的口服生物利用度(50-60%)、高分布容積(6.2 L/kg),終末半衰期為 8 至 11 小時。 [13]由於瑞替加濱的半衰期短,因此需要每日三次給藥。 [12] [7] [11]
歷史
編輯在較新的抗驚厥藥中,瑞替加濱是臨床前研究最廣泛的藥物之一:在臨床試驗開始之前,它是 100 多項已發表研究的主題。在臨床前測試中,發現它具有非常廣泛的活性,對幾乎所有使用的癲癇發作和癲癇動物模型都有效:瑞替加濱抑制由電擊、杏仁核電點燃、戊四氮、紅藻氨酸、 NMDA和印防己毒素。 [17]研究人員希望這種廣泛的活動也能轉化為人類研究。 [12]
臨床試驗
編輯瑞替加濱被用於 399 名患有部分性癲癇發作且對其他抗癲癇藥物治療無效的受試者的治療方案中,在一雙盲、安慰劑對照的II 期臨床試驗中。接受瑞替加濱的參與者癲癇發作頻率顯著降低(減少 23% 至 35%),大約四分之一至三分之一的參與者癲癇發作頻率降低超過 50%。較高劑量與較高的治療反應相關。 [12] [8] [7]
旨在評估瑞替加濱治療帶狀疱疹後神經痛的安全性和有效性的II 期試驗於 2009 年完成,但未能達到其主要終點。 Valeant 報告稱初步結果「尚無定論」。 [18]
監管審批
編輯於2009年12月30日,美國FDA接受了Valeant的瑞替加濱新藥申請[19] FDA 的神經系統藥物諮詢委員會於 2010 年 8 月 11 日召開會議,建議批准 Potiga 用於預期適應症(成人部分性癲癇發作的附加治療)。 [20] [21]
然而,尿瀦留作為不良反應的可能性被認為是一個重大問題,專家組成員建議採用某種監測策略來識別有膀胱功能障礙風險的患者。 [20] Potiga 於 2010 年 6 月 10 日獲得 FDA 批。 [10]
2011 年 12 月,美國緝毒局(DEA) 將該物質列入《管制物質法》 (CSA) 附表 V,該物質屬於濫用可能性相對較低的類別。該規定於 2011 年 12 月 15 日生效。 [22]
參考文獻
編輯- ^ Ferron GM, Paul J, Fruncillo R, Richards L, Knebel N, Getsy J, Troy S. Multiple-dose, linear, dose-proportional pharmacokinetics of retigabine in healthy volunteers. Journal of Clinical Pharmacology. February 2002, 42 (2): 175–182. PMID 11831540. S2CID 5568963. doi:10.1177/00912700222011210.
- ^ POTIGA (ezogabine) Tablets, CV. Full Prescribing Information (PDF). GlaxoSmithKline and Valeant Pharmaceuticals. [4 June 2014]. (原始內容存檔 (PDF)於2016-03-21).
- ^ 3.0 3.1 Rundfeldt C. The new anticonvulsant retigabine (D-23129) acts as an opener of K+ channels in neuronal cells. European Journal of Pharmacology. October 1997, 336 (2–3): 243–249. PMID 9384239. doi:10.1016/S0014-2999(97)01249-1.
- ^ 4.0 4.1 Main MJ, Cryan JE, Dupere JR, Cox B, Clare JJ, Burbidge SA. Modulation of KCNQ2/3 potassium channels by the novel anticonvulsant retigabine. Molecular Pharmacology. August 2000, 58 (2): 253–262. PMID 10908292. S2CID 11112809. doi:10.1124/mol.58.2.253.
- ^ 5.0 5.1 Rogawski MA, Bazil CW. New molecular targets for antiepileptic drugs: alpha(2)delta, SV2A, and K(v)7/KCNQ/M potassium channels. Current Neurology and Neuroscience Reports. July 2008, 8 (4): 345–352. PMC 2587091 . PMID 18590620. doi:10.1007/s11910-008-0053-7.
- ^ Epilepsy drug Trobalt (retigabine) to be discontinued. epilepsysociety.org.uk. 14 September 2016 [2023-11-07]. (原始內容存檔於2023-10-10).
- ^ 7.0 7.1 7.2 Plosker GL, Scott LJ. Retigabine: in partial seizures. CNS Drugs. 2006, 20 (7): 601–8; discussion 609–10. PMID 16800718. doi:10.2165/00023210-200620070-00005.
- ^ 8.0 8.1 Porter RJ, Partiot A, Sachdeo R, Nohria V, Alves WM. Randomized, multicenter, dose-ranging trial of retigabine for partial-onset seizures. Neurology. April 2007, 68 (15): 1197–1204. PMID 17420403. S2CID 24574886. doi:10.1212/01.wnl.0000259034.45049.00.
- ^ Potiga (Ezogabine): Drug Safety Communication. Food and Drug Administration. [2023-11-07]. (原始內容存檔於2017-04-06).
- ^ 10.0 10.1 Hitt E. FDA approves ezogabine for seizures in adults. Medscape. 2011-06-13 [2011-06-13]. (原始內容存檔於2023-10-10).
- ^ 11.0 11.1 11.2 11.3 11.4 Trobalt – Summary of Product Characteristics (SPC). electronic Medicines Compendium. 2011-05-05 [2011-06-13]. (原始內容存檔於2017-08-06).
- ^ 12.0 12.1 12.2 12.3 Ben-Menachem E. Retigabine: has the orphan found a home?. Epilepsy Currents. 2007, 7 (6): 153–154. PMC 2096728 . PMID 18049722. doi:10.1111/j.1535-7511.2007.00209.x.
- ^ 13.0 13.1 13.2 Luszczki JJ. Third-generation antiepileptic drugs: mechanisms of action, pharmacokinetics and interactions. Pharmacological Reports. 2009, 61 (2): 197–216. PMID 19443931. S2CID 72918370. doi:10.1016/s1734-1140(09)70024-6.
- ^ Corbin-Leftwich A, Mossadeq SM, Ha J, Ruchala I, Le AH, Villalba-Galea CA. Retigabine holds KV7 channels open and stabilizes the resting potential. The Journal of General Physiology. March 2016, 147 (3): 229–241. PMC 4772374 . PMID 26880756. doi:10.1085/jgp.201511517.
- ^ Villalba-Galea CA. Modulation of KV7 Channel Deactivation by PI(4,5)P2. Frontiers in Pharmacology. 2020-06-19, 11: 895. PMC 7318307 . PMID 32636742. doi:10.3389/fphar.2020.00895 .
- ^ Brown DA, Passmore GM. Neural KCNQ (Kv7) channels. British Journal of Pharmacology. April 2009, 156 (8): 1185–1195. PMC 2697739 . PMID 19298256. doi:10.1111/j.1476-5381.2009.00111.x.
- ^ Rogawski MA. Diverse mechanisms of antiepileptic drugs in the development pipeline. Epilepsy Research. June 2006, 69 (3): 273–294. PMC 1562526 . PMID 16621450. doi:10.1016/j.eplepsyres.2006.02.004.
- ^ Valeant Pharmaceuticals Announces Preliminary Results From Its Phase IIa Retigabine Study for the Treatment of Postherpetic Neuralgia (PHN) (新聞稿). PRNewswire. 2009-08-24 [2011-06-13]. (原始內容存檔於2016-09-21).
- ^ Retigabine NDA accepted for filing (新聞稿). PRNewswire. 2009-12-30 [2010-07-19]. (原始內容存檔於2023-10-10).
- ^ 20.0 20.1 Lowry F. Epilepsy drug exogabine gets green light from FDA Advisory Panel. Medscape. 2010-08-12 [2010-08-13]. (原始內容存檔於2023-10-10).
- ^ [No authors listed]. August 11, 2010: Peripheral and Central Nervous System Drugs Advisory Committee Meeting Announcement. U.S. Food and Drug Administration. 2010-06-25 [2010-07-19]. (原始內容存檔於2017-07-22).
- ^ U.S. Drug Enforcement Administration. Schedules of Controlled Substances: Placement of Ezogabine Into Schedule V (PDF). Federal Register. 15 December 2011, 76 (241) [2023-11-07]. (原始內容存檔 (PDF)於2017-06-16).