阿瑞匹坦
阿瑞匹坦(英語:Aprepitant),是一種用於預防化療引起的噁心和嘔吐,以及預防手術後噁心和嘔吐的藥物。[5]它可與昂丹司瓊(一種減少手術、化療、放射治療後噁心與嘔吐的藥物)和地塞米松(常被用作抑制或防止藥物過敏反應的藥物)一起使用。[5]此藥物經口服[5]或靜脈注射方式給藥。[3]
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | 化療止吐藥(英語:Emend、Cinvanti和Aponvie) |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a604003 |
| 核准狀況 | |
| 懷孕分級 |
|
| 給藥途徑 | 口服給藥,靜脈注射 |
| 藥物類別 | 神經激肽-1拮抗劑,止吐劑 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 60–65% |
| 血漿蛋白結合率 | >95% |
| 藥物代謝 | 肝臟 ( 絕大部分由CYP3A4介導,部分由CYP2C19及CYP1A2)介導) |
| 生物半衰期 | 9–13小時 |
| 排泄途徑 | 腎臟 (57%), 糞便 (45%)(口服給藥) |
| 識別資訊 | |
| |
| CAS號 | 170729-80-3 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.202.762 |
| 化學資訊 | |
| 化學式 | C23H21F7N4O3 |
| 摩爾質量 | 534.43 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
使用後常見的副作用有疲倦、食慾不振、腹瀉、腹痛、打嗝、搔癢、肺炎和血壓變化。[5]其他嚴重的副作用有過敏性休克。[5]雖然個體在懷孕期間使用似乎對胎兒沒害處,但於此尚未有充分研究。[6]阿瑞匹坦屬於神經激肽-1受體拮抗劑藥物類別。[5]其作用是阻止P物質附著在速激受體-1(又稱神經激肽-1受體)上。[5]P物質是種屬於速激肽家族的神經肽。[4]
此藥物於2003年在歐盟和美國獲准用於醫療用途,[5][4]製造商為默克公司。[5]它已被納入世界衛生組織基本藥物標準清單之中。[7][8]
醫療用途
編輯作用機轉
編輯阿瑞吡坦是一種神經激肽-1受體拮抗劑,可阻斷神經激肽-1受體發出的訊號,而降低使用者嘔吐的可能。[9]
神經激肽-1是一種G蛋白偶聯受體,同時存於中樞和周邊神經系統中。這個受體有一稱為P物質 (SP) 的主要配體。 SP是一種神經肽,由11種胺基酸(稱為十一肽)組成,負責向大腦發送脈衝和訊息。它在大腦的孤束核區(負責偵測與嘔吐相關的激素等)中濃度很高,當被活化時,會導致嘔吐反射。[10]除此之外,SP還在疼痛脈衝從周邊邊神經受體傳遞到中樞神經系統過程中發揮關鍵作用。[11]
阿瑞匹坦已被證明可透過阻斷P物質落在大腦神經元受體上來抑制細胞毒性化療藥物所引起的急性和延遲性嘔吐。經由正子斷層造影 (PET) 研究顯示阿瑞匹坦可穿過血腦屏障,並與人類大腦中的神經激肽-1受體結合。[12]此藥物也被證明可增加5-HT3受體拮抗劑 - 昂丹司瓊和皮質類固醇地塞米松的活性,這兩種藥物也用於預防化療引起的噁心和嘔吐。[13]
藥物動力學
編輯對一類新型治療劑進行臨床測試之前,必須進行臨床前代謝和排泄研究。此藥物的生物利用度平均約為60-65%。阿瑞匹坦主要經由細胞色素CYP3A4代謝,少量由細胞色素CYP1A2和CYP2C19代謝。目前已在人類血漿中鑑定出阿瑞匹坦的七種代謝產物,它們的活性皆較弱。阿瑞匹坦是CYP3A4的中度抑制劑,因此可增加經由共同給藥時,原來會被CYP3A4代謝的藥物血漿濃度。已證實阿瑞匹坦與羥考酮有特異性交互作用,前者既能提高後者的療效,又會將後者的副作用加劇。然而尚不清楚這是由於阿瑞匹坦對CYP3A4抑制還是透過其神經激肽-1拮抗劑作用所致。[14]靜脈注射攜帶有碳-14標記的阿瑞匹坦前藥 (L-758298) 後,這種前藥會迅速且完全轉化為阿瑞匹坦,約57%的總放射性經由尿液排出,45%經由糞便排出。未在排泄的尿液中發現有原形藥物存在。[15]
禁忌症
編輯對於阿瑞匹坦任何成分過敏的患者禁用此藥物。此藥物是一種CYP3A4的劑量依賴性抑制劑。CYP3A4在人體中負責代謝多種藥物。當阿瑞匹坦與其他藥物同時使用時,它會競爭性與CYP3A4結合,而抑制其他藥物的代謝,導致血液中藥物濃度升高,提升不良反應的風險。阿瑞匹坦不應與匹莫齊特、特非那定、阿司咪唑或西沙必利同時使用。[16]
結構與性質
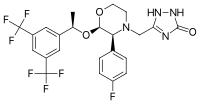
編輯阿瑞吡坦由一嗎啉核心,兩個取代基連接到相鄰的環碳。這些取代基是三氟甲基化1-苯基乙醇和氟苯基。阿瑞匹坦還有第三個取代基(三唑啉酮),與嗎啉環氮相連。它有三個非常靠近的立體中心,結合產生胺基酸排列。其實驗式為C23H21F7N4O3。
合成
編輯當默克製藥開始研究降低化療引起的噁心和嘔吐程度和可能性後不久,就發現阿瑞匹坦有效。雖然研究人員在短時間內找到有效合成方法,但過程過於複雜,且會產生危險副產品,因而決定將藥物從臨床實驗中撤回。不久後,默克的研究人員團隊提出一種替代性、更環保的阿瑞吡坦合成方法。[17]這種簡化製程比原始製程的產量提高約76%,也節省溶劑與試劑用量,顯著降低營運成本。由於製程中排除使用幾項危險化學品,也減少對自然環境造成長期損害。
歷史
編輯此藥物於2003年獲得美國食品藥物管理局(FDA)批准作醫療用途。[18]阿瑞匹坦的靜脈注射形式福沙匹坦(為前者的前藥)於2008年在美國獲准用作醫療用途。[19]
通用名藥物
編輯市場上有幾種通用名藥物流通(均為口服膠囊製劑),包括兩家印度藥廠 - Glenmark Pharmaceuticals Limited與Torrent Pharmaceuticals,以及瑞士山德士製藥所產。[20]
研究
編輯重度憂鬱症
編輯開發阿瑞吡坦作為抗憂鬱藥物的計畫已被撤回。[21]隨後使用其他神經激肽-1拮抗劑 - 卡索匹坦和奧維匹坦兩項,臨床試驗數據支持其治療潛力。[22][23][24]
大麻素劇吐症候群
編輯阿普瑞匹坦已被確定具甚高的潛力以治療大麻類劇吐症候群患者的長期嘔吐發作。[25]這種劇吐症狀的特徵是長期頻繁使用大麻而導致的噁心、周期性嘔吐和腹部絞痛。[26][27]
參考文獻
編輯- ^ Emend- aprepitant capsule Emend- aprepitant kit Emend- aprepitant powder, for suspension. DailyMed. 2022-05-06 [2022-09-27]. (原始內容存檔於2022-03-09).
- ^ Cinvanti- aprepitant injection, emulsion. DailyMed. 2022-03-24 [2022-09-27]. (原始內容存檔於2022-08-31).
- ^ 3.0 3.1 Aponvie (aprepitant) injectable emulsion, for intravenous use Initial U.S. Approval: 2003 (PDF). [2022-09-28]. (原始內容存檔 (PDF)於2022-09-28).
- ^ 4.0 4.1 4.2 Emend EPAR. European Medicines Agency. 2018-09-17 [2019-10-13]. (原始內容存檔於2020-11-12).
- ^ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 Aprepitant/Fosaprepitant Dimeglumine Monograph for Professionals. Drugs.com. [2019-10-13]. (原始內容存檔於2020-08-13).
- ^ Aprepitant Use During Pregnancy. Drugs.com. [2019-10-13]. (原始內容存檔於2020-10-28).
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ World Health Organization. World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. 2021. hdl:10665/345533 . WHO/MHP/HPS/EML/2021.02.
- ^ Fosaprepitant. PubChem. [2024-08-16].
- ^ Hornby PJ. Central neurocircuitry associated with emesis. The American Journal of Medicine. Dec 2001, 111 (8 Suppl 8A): 106S–112S. PMID 11749934. doi:10.1016/S0002-9343(01)00849-X.
- ^ De Felipe C, Herrero JF, O'Brien JA, Palmer JA, Doyle CA, Smith AJ, Laird JM, Belmonte C, Cervero F, Hunt SP. Altered nociception, analgesia and aggression in mice lacking the receptor for substance P. Nature. Mar 1998, 392 (6674): 394–7. Bibcode:1998Natur.392..394D. PMID 9537323. S2CID 4324247. doi:10.1038/32904.
- ^ Bergström M, Hargreaves RJ, Burns HD, Goldberg MR, Sciberras D, Reines SA, Petty KJ, Ogren M, Antoni G, Långström B, Eskola O, Scheinin M, Solin O, Majumdar AK, Constanzer ML, Battisti WP, Bradstreet TE, Gargano C, Hietala J. Human positron emission tomography studies of brain neurokinin 1 receptor occupancy by aprepitant. Biological Psychiatry. May 2004, 55 (10): 1007–1012. PMID 15121485. S2CID 21071199. doi:10.1016/j.biopsych.2004.02.007.
- ^ Gralla RJ, de Wit R, Herrstedt J, Carides AD, Ianus J, Guoguang-Ma J, Evans JK, Horgan KJ. Antiemetic efficacy of the neurokinin-1 antagonist, aprepitant, plus a 5HT3 antagonist and a corticosteroid in patients receiving anthracyclines or cyclophosphamide in addition to high-dose cisplatin: analysis of combined data from two Phase III randomized clinical trials. Cancer. August 2005, 104 (4): 864–868. PMID 15973669. S2CID 24860776. doi:10.1002/cncr.21222 .
- ^ Walsh SL, Heilig M, Nuzzo PA, Henderson P, Lofwall MR. Effects of the NK1 antagonist, aprepitant, on response to oral and intranasal oxycodone in prescription opioid abusers. Addiction Biology. March 2013, 18 (2): 332–343. PMC 4354863 . PMID 22260216. doi:10.1111/j.1369-1600.2011.00419.x.
- ^ FDA Advisory Committee Background Package (PDF). Food and Drug Administration. [2019-12-16]. (原始內容存檔 (PDF)於2017-05-16).
- ^ HIGHLIGHTS OF PRESCRIBING INFORMATION EMEND (aprepitant) Capsules (PDF). Merck Sharp & Dohme Corp. March 2010 [2024-08-16].
- ^ Hargreaves R, Ferreira JC, Hughes D, Brands J, Hale J, Mattson B, Mills S. Development of aprepitant, the first neurokinin-1 receptor antagonist for the prevention of chemotherapy-induced nausea and vomiting. Annals of the New York Academy of Sciences. March 2011, 1222 (1): 40–48. Bibcode:2011NYASA1222...40H. PMID 21434941. S2CID 21202644. doi:10.1111/j.1749-6632.2011.05961.x.
- ^ Drug Approval Package: Emend (Aprepitant) NDA #21-549. [2011-04-19]. (原始內容存檔於2017-03-24).
- ^ Colon-Gonzalez, Francheska; Kraft, Walter K. Pharmacokinetic evaluation of fosaprepitant dimeglumine. Expert Opinion on Drug Metabolism & Toxicology. October 2010, 6 (10): 1277–1286 [2024-08-16]. doi:10.1517/17425255.2010.513970.
- ^ Generic Emend Availability. Drugs.com. 2024-08-07 [2024-08-17].
- ^ Rupniak NM, Kramer MS. NK1 receptor antagonists for depression: Why a validated concept was abandoned. Journal of Affective Disorders. December 2017, 223: 121–125. PMID 28753469. doi:10.1016/j.jad.2017.07.042.
- ^ Ratti E, Bellew K, Bettica P, Bryson H, Zamuner S, Archer G, Squassante L, Bye A, Trist D, Krishnan KR, Fernandes S. Results from 2 randomized, double-blind, placebo-controlled studies of the novel NK1 receptor antagonist casopitant in patients with major depressive disorder. Journal of Clinical Psychopharmacology. December 2011, 31 (6): 727–733. PMID 22020354. S2CID 24609826. doi:10.1097/JCP.0b013e31823608ca.
- ^ Trist DG, Ratti E, Bye A. Why receptor reserve matters for neurokinin1 (NK1) receptor antagonists. Journal of Receptor and Signal Transduction Research. December 2013, 33 (6): 333–337. PMID 24106886. S2CID 21799710. doi:10.3109/10799893.2013.843194.
- ^ Ratti E, Bettica P, Alexander R, Archer G, Carpenter D, Evoniuk G, Gomeni R, Lawson E, Lopez M, Millns H, Rabiner EA, Trist D, Trower M, Zamuner S, Krishnan R, Fava M. Full central neurokinin-1 receptor blockade is required for efficacy in depression: evidence from orvepitant clinical studies. Journal of Psychopharmacology. May 2013, 27 (5): 424–434. PMID 23539641. S2CID 6523822. doi:10.1177/0269881113480990.
- ^ Barrett JS, McGuire J, Vezina H, Spitsin S, Douglas SD. PET measurement of receptor occupancy as a tool to guide dose selection in neuropharmacology: are we asking the right questions?. Journal of Clinical Psychopharmacology. December 2013, 33 (6): 725–728. PMID 24100788. doi:10.1097/JCP.0b013e3182a88654.
- ^ Sorensen, Cecilia J.; DeSanto, Kristen; Borgelt, Laura; Phillips, Kristina T.; Monte, Andrew A. Cannabinoid Hyperemesis Syndrome: Diagnosis, Pathophysiology, and Treatment—a Systematic Review. Journal of Medical Toxicology. 2016-12-20, 13 (1): 71–87. PMC 5330965 . PMID 28000146. doi:10.1007/s13181-016-0595-z.
- ^ DeVuono, Marieka; Parker, Linda. Cannabinoid Hyperemesis Syndrome: A Review of Potential Mechanisms. Cannabis and Cannabinoid Research. 2020, 5 (2): 132–144. PMC 7347072 . PMID 32656345. doi:10.1089/can.2019.0059.
- ^ Ruberto AJ, Sivilotti ML, Forrester S, Hall AK, Crawford FM, Day AG. Intravenous Haloperidol Versus Ondansetron for Cannabis Hyperemesis Syndrome (HaVOC): A Randomized, Controlled Trial. Annals of Emergency Medicine. June 2021, 77 (6): 613–619. PMID 33160719. S2CID 226287931. doi:10.1016/j.annemergmed.2020.08.021.