用户:Rockpelt/烷烃新版

烷烃(拼音:Wán-tīng;英文:Alkane[3])是碳氢化合物下的一种饱和烃,其整体构造大多仅由碳、氢、碳-碳单键与碳氢单键所构成[4],同时也是最简单的一种有机化合物,而其下又可细分出链烷烃与环烷烃。
得名
编辑“烷”(Wán、ㄨㄢˊ[5]),是化学家取“碳”右下角之火,加上“完”以造出的字。“碳”表示其结构中含有碳,而“完”表示其分子结构中碳原子化合价完足的意思[6]。
性质概论
编辑烷类皆难溶于水,在完全燃烧下可转化为二氧化碳和水[7],反应式如下:
烷类会因组合结构的不同,其性质可能会有极大的差异。若结构相似,则性质相近;若结构不同,性质不同。[7]正因此,烷类种类繁多;但也由此许多化学式相同的物质,其性质不相同。如戊烷( )[8]:
| 正戊烷 戊烷 |
异戊烷 2-甲基丁烷 |
新戊烷 2,2-二甲基丙烷 |
物理性质
编辑烷烃有许多物理性质:
- 密度皆小于一。
- 不溶于水,但溶于有机溶剂。
- 熔点与沸点随著分子量增大和碳链增长而升高,同碳数的烷烃,支链越多沸点越低。
- 一般情况下,碳数小于5的(甲烷到丁烷)为气态,5-17之间的(戊烷到十七烷)为液态,18个碳(十八烷)以上为固态。[9]
| 烷烃 | 公式 | 沸点 [°C] | 熔点 [°C] | 20°C下的状态 | 密度 [g·cm3] |
| 甲烷 | CH4 | -162 | -183 | 气体 | --- |
| 乙烷 | C2H6 | -89 | -182 | 气体 | --- |
| 丙烷 | C3H8 | -42 | -188 | 气体 | --- |
| 丁烷 | C4H10 | 0 | -138 | 气体 | --- |
| 戊烷 | C5H12 | 36 | -130 | 液体 | 0.626 |
| 正己烷 | C6H14 | 69 | -95 | 液体 | 0.659 |
| 庚烷 | C7H16 | 98 | -91 | 液体 | 0.684 |
| 辛烷 | C8H18 | 126 | -57 | 液体 | 0.703 |
| 壬烷 | C9H20 | 151 | -54 | 液体 | 0.718 |
| 癸烷 | C10H22 | 174 | -30 | 液体 | 0.730 |
| 十一烷 | C11H24 | 196 | -26 | 液体 | 0.740 |
| 十二烷 | C12H26 | 216 | -10 | 液体 | 0.749 |
| 二十烷 | C20H42 | 343 | 37 | 固体 | --- |
| 三十烷 | C30H62 | 450 | 66 | 固体 | --- |
| 四十烷 | C40H82 | 525 | 82 | 固体 | --- |
| 五十烷 | C50H102 | 575 | 91 | 固体 | --- |
化学性质
编辑烷烃性质很稳定,因为碳-氢键和碳-碳键相对稳定,难以断裂。[10]除了下面三种反应,烷烃几乎不能进行其他反应。
氧化反应
编辑反应通式: [11]
所有的烷烃都能燃烧,而且反应放热极多。[12]烷烃完全燃烧生成-CO2和H2O[7]。如果O2的量不足,就会产生有毒气体一氧化碳(CO),甚至炭黑(C)。[13]
以甲烷为例:
- CH4 + 2 O2 → CO2 + 2 H2O
O2供应不足时,反应如下:
- 2CH4 + 3 O2 → 2CO + 4 H2O
- CH4 + O2 → C + 2 H2O
分子量大的烷烃经常不能够完全燃烧,它们在燃烧时会有黑烟产生,就是炭黑。
卤化反应
编辑反应通式: [14]
由于烷烃的结构太牢固,一般的有机反应不能进行。烷烃的卤代反应是一种自由基取代反应,反应的起始需要光能来产生自由基。
以下是甲烷被卤代的步骤。这个高度放热的反应可以引起爆炸。
- 链引发阶段:在紫外线的催化下形成两个Cl的自由基
- Cl2 → Cl* / *Cl
- Cl2 → Cl* / *Cl
- 链增长阶段:一个H原子从甲烷中脱离;CH3Cl开始形成。
- CH4 + Cl* → CH3+ + HCl (慢)
- CH3+ + Cl2 → CH3Cl + Cl*
- 链终止阶段:两个自由基重新组合
- Cl* 和 Cl*, 或
- R* 和 Cl*, 或
- CH3* 和 CH3*.[15]
裂解反应
编辑裂化反应是大分子烃在高温、高压或有催化剂的条件下,分裂成小分子烃的过程。裂化反应属于消除反应,因此烷烃的裂化总是生成烯烃。如十六烷(C16H34)经裂化可得到辛烷(C8H18)和辛烯(C8H16)。
由于每个键的环境不同,断裂的机率也就不同,下面以丁烷的裂化为例讨论这一点:
- CH3-CH2-CH2-CH3 → CH4 + CH2=CH-CH3
- 过程中CH3-CH2键断裂,可能性为48%;
- CH3-CH2-CH2-CH3 → CH3-CH3 + CH2=CH2
- 过程中CH2-CH2键断裂,可能性为38%;
- CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2
- 过程中C-H键断裂,可能性为14%。[15]
裂化反应中,不同的条件能引发不同的机理,但反应过程类似。热分解过程中有碳自由基产生,催化裂化过程中产生碳正离子和氢负离子。这些极不稳定的中间体经过重排、键的断裂、氢的转移等步骤形成稳定的小分子烃。
在工业中,深度的裂化叫做裂解,裂解的产物都是气体,称为裂解气。
命名
编辑烷类的命名多采IUPAC命名法。
命名烷类的首要步骤是分析其为环状亦或是链状,再进行命名步骤。[16]
链烷烃
编辑化学通式: [17]
链烷烃的命名步骤为:
- 找出最长的碳链当主链,依碳数命名主链,前十个以天干[18]代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
- 从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。以数字代表取代基的位置。数字与中文数字之间以 - 隔开。
- 有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙基、丙基的顺序列出所有取代基。
- 有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以“,”(逗号)隔开,一起列于取代基前面。
因为烷类一般简单,故亦会使用“正、异、新”去区隔同样化学式的烷类。IUPAC也曾推荐过此种命名方式[19]。如例己烷命名方式:
| 普通命名 | IUPAC命名 | 结构简式 | 结构式 |
|---|---|---|---|
| 己烷、 正己烷 |
己烷 | CH3(CH2)4CH3 | [20] |
| 异己烷 | 2-甲基戊烷 | (CH3)2CH(CH2)2CH3 | [21] |
| 新己烷 | 2,2-二甲基丁烷 | CH3C(CH3)2CH2CH3 | [22] |
环烷烃
编辑环烷烃的命名方式和烷类方式相同,仅需在前添加一环字,以做识别。如例环丙烷:
结构
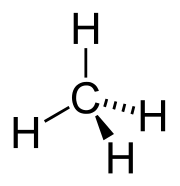
编辑烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体。甲烷是标准的正四面体形态,其键角为 ),大约等于109°28′。[24]
下面是前10种直链烷烃的分子式和结构模型图。
异构体
编辑[[Image:Saturated C4 hydrocarbons ball-and-stick.png|thumb|right| 不同的四碳烃类(从左到右): 正丁烷和异丁烷为同素异构体,化学式皆为C4H10;环丁烷和异丁烯为同素异构体,化学式皆为C4H8
双环[1.1.0]丁烷是唯一化学式为C4H6的烃类。]]
超过3个碳原子的烷烃可以以多种方式排列,形成同素异构体。
应用
编辑工业上的应用
编辑由于烷烃的制取成本较高(一般要用烯烃催化加氢),所以在工业上不制取烷烃,而是直接从石油中提取。由于烷烃不易发生反应,所以工业上也不把它作为化工基本原料。
烷烃的作用主要是做燃料。天然气和沼气(主要成分为甲烷)是近来广泛使用的清洁能源。石油分馏得到的各种馏分适用于各种发动机:
- C1~C4(40℃以下时的馏分)是石油气,可作为燃料;
- C5~C11(40~200℃时的馏分)是汽油,可作为燃料,也可作为化工原料;
- C9~C18(150~250℃时的馏分)是煤油,可作为燃料;
- C14~C20(200~350℃时的馏分)是柴油,可作为燃料;
- C20以上的馏分是重油,再经减压蒸馏能得到润滑油、沥青等物质。[26]
其他
编辑- 异辛烷是汽油抗爆震度的一个标准,其辛烷值定为100。
参看
编辑注释与参考资料
编辑- ^ 国二下自然与生活科技(康轩版), 第四册. 第四章. 有机化合物.
- ^ Kim, S. J.; Caldwell, J.; Rivolo, A. R.; Wagner, R. Infrared Polar Brightening on Jupiter III. Spectrometry from the Voyager 1 IRIS Experiment. Icarus. 1985, 64: 233–48 [2007-08-28]. doi:10.1016/0019-1035(85)90201-5.
- ^ http://tw.dictionary.yahoo.com/dictionary?p=%E7%83%B7%E7%83%B4
- ^ http://chem188.cn/Article/ShowArticle.asp?ArticleID=3409,其中亦有可能出現卤素,因为其价数和氢原子相同,为+1,所以可以取代氢原子。
- ^ http://www.zdic.net/zd/zi/ZdicE7Zdic83ZdicB7.htm
- ^ http://dict.revised.moe.edu.tw/cgi-bin/newDict/dict.sh?cond=%D6J&pieceLen=50&fld=1&cat=&ukey=1359251432&serial=2&recNo=7&op=f&imgFont=1
- ^ 7.0 7.1 7.2 许立仑、许喆翔. 《國中自然與生活科技 第四冊學習講義》P138. 康轩文教事业.
- ^ [1]
- ^ https://docs.google.com/viewer?a=v&q=cache:VNeEGYgHSAoJ:jpkc.rzpt.cn/top15/wf/ziyuan/jiaoan/youji/2.doc+%E7%83%B7%E7%83%B4+%E5%AF%86%E5%BA%A6&hl=zh-TW&gl=tw&pid=bl&srcid=ADGEESgwCXS896phlvYvMEUsuGVfFWelQctjPhtUlq7LoWdj0GoQugTMV-O9aS4WfYx7oRYa8wFxnB0aLhMGCxoYcAeJa6e6JH6657SgpAjIZflHlpoxf-yAVjNc3-4Y7sHWhoMFDcvL&sig=AHIEtbRFi8bogIirNN7rq5sNcGoavpLDUA
- ^ Google 图书-有机化学
- ^ R即为烷烃
- ^ http://content.edu.tw/senior/chemistry/tp_sc/new/14/2.htm
- ^ http://highscope.ch.ntu.edu.tw/wordpress/?p=28419
- ^ X即为卤素
- ^ 15.0 15.1 https://docs.google.com/viewer?a=v&q=cache:UylIK0hlBXMJ:163.23.148.7/sweb/pub/downfiles.php%3Frec_id%3D176%26rel_nm%3D1%26account%3Djiahui+%E7%83%B7%E9%A1%9E+%E7%87%83%E7%87%92&hl=zh-TW&gl=tw&pid=bl&srcid=ADGEESjVn_S4UBj386pOI7NtQloiuyGfCymgttRAfWW2AE_PJB9awjuKFypwR0q1w3QyFOwcCqsao9NApFyloGNUquPoILBB4iZ2ZHgi_DLolYLdP7zuIRY4qYXTKkczeEWQbTLiXZv4&sig=AHIEtbTaNJ-0RUBSkexAGhzfaapV4QNrZQ
- ^ 参考自IUPAC命名法
- ^ Silderberg, 623
- ^ 甲、乙、丙、丁、戊、己、庚、辛、壬、癸
- ^ Panico, R.; & Powell, W. H. (Eds.). A Guide to IUPAC Nomenclature of Organic Compounds 1993. Oxford: Blackwell Science. 1994. ISBN 0-632-03488-2.
- ^ http://www.chemyq.com/xz/xz3/26801vrqct.htm
- ^ http://www.chemyq.com/xz/xz2/18788ihnsq.htm
- ^ http://www.chemblink.com/products/75-83-2C.htm
- ^ Merck Index, 11th Edition, 2755.
- ^ http://www.hxzxs.cn/html/3018.html
- ^ Meierhenrich, U. Amino Acids and the Asymmetry of Life. Springer. 2008 [18 October 2008]. ISBN 978-3-540-76885-2.
- ^ [2]
| |||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||