皮肤菌群
皮肤菌群(英语:Skin flora)也称为皮肤微生物群(英语:Skin microbiota),通常是指存在于人类皮肤上的微生物群落。
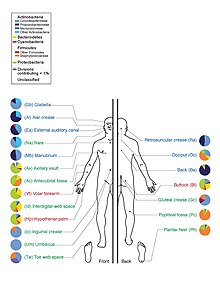
其中占大多数的是细菌,人体皮肤上约有1000种细菌,分别来自19个门。[1][2]大多数存在于表皮的表层和毛囊的上部。
皮肤菌群通常是非致病性的,并且是偏利共生(对宿主无害)或互惠共生的(双方获益)。细菌可以提供的好处包括通过竞争营养、分泌化学物质或刺激皮肤的免疫系统以防止短暂的致病生物在皮肤表面定殖。[3]然而,常驻微生物也可能引起皮肤病并进入血液系统,造成危及生命的疾病,尤其是在免疫抑制人群中。[3]
一种主要的非人类皮肤菌群是蛙壶菌(Batrachochytrium dendrobatidis),这是一种壶菌和非菌丝游动孢子真菌,可引起壶菌病。这种传染病被认为是导致兩棲動物種群減少的原因。[4]
物种种类
编辑细菌
编辑通过使用16S核糖体RNA直接从遗传物质中识别皮肤样本上存在的细菌种类,对皮肤细菌物种数量的估计发生了根本性的改变。以前,这种鉴定依赖于微生物培养,而许多种类的细菌不会在微生物培养中生长,因此对科学界来说是隐藏的。[1]
以往基于培养的研究认为表皮葡萄球菌和金黄色葡萄球菌是主导物种。然而,16S核糖体RNA研究发现,这两个物种虽然常见,但也仅占皮肤细菌的5%。[5]皮肤多样性提供给细菌丰富多样的栖息地。大多细菌都数来自四个门,即放线菌门(51.8%)、厚壁菌门(24.4%)、假单胞菌门(16.5%)和拟杆菌门(6.3%)。[來源請求]
皮肤有三个主要的生态区:皮脂腺、湿润和干燥。丙酸杆菌和葡萄球菌是皮脂腺区的主要菌种。在身体潮湿的地方,棒状杆菌和葡萄球菌占主导地位。而在身体干燥的地方存在多种物种,但β-变形菌和黄杆菌占主导地位。在生态学上,皮脂腺区域的物种丰富度高于潮湿和干燥区域。人与人之间物种相似度最低的区域是手指间隙、脚趾间隙、腋窝和脐带残端。而最相似的是鼻孔旁边、鼻孔内部和背部。[1]
| 生物名称 | 观察 | 致病性 |
|---|---|---|
| 表皮葡萄球菌 | 常见的 | 偶尔是致病的 |
| 金黄色葡萄球菌 | 不常见 | 通常是致病的 |
| 沃氏葡萄球菌 | 不常见 | 偶尔是致病的 |
| 化脓性链球菌 | 不常见 | 通常是致病的 |
| 缓症链球菌 | 频繁 | 偶尔是致病的 |
| 痤疮丙酸杆菌 | 频繁 | 偶尔是致病的 |
| 棒状杆菌属的物种 | 频繁 | 偶尔是致病的 |
| 乙酸钙不动杆菌 | 频繁 | 偶尔是致病的 |
| 绿脓杆菌 | 不常见 | 偶尔是致病的 |
真菌
编辑一项对100名年轻人脚趾间区域的研究发现了14种不同的真菌。这些包括酵母菌,例如白色念珠菌、深红酵母和皮状丝孢酵母;皮癣菌真菌,例如石膏样小孢子菌和红色毛癣菌;非皮癣菌真菌,例如黑根霉、皮状丝孢酵母、镰孢菌、短柄帚霉、弯孢、链格孢菌、拟青霉、黄曲霉和青霉菌物种。[6]
美国马里兰州贝塞斯达的国家人类基因组研究所进行了一项研究,调查了人体14个不同位置的皮肤真菌的DNA。这些位置分别是耳道、眉毛之间、后脑勺、耳后、脚跟、脚趾甲、脚趾之间、前臂、背部、腹股沟、鼻孔、胸部、手掌和肘窝。研究表明,人体各个部位的真菌种类繁多,其中最丰富的栖息地是脚跟,那里有大约80种真菌。相比之下,脚趾甲上有大约60种物种,而脚趾之间有40种物种。其他富含真菌的区域包括手掌、前臂和肘窝内,其真菌物种数在18到32种之间。头部和躯干各有2到10种。[7]
脐带的微生物组
编辑肚脐是身体的一个部位。肚脐很少暴露于紫外线、肥皂或身体分泌物(肚脐不产生任何分泌物或油脂)[8][9],由于它是一个几乎不受干扰的细菌群落[10],所以它是研究皮肤微生物组的一个很好的部位。[11]肚脐是人体的潮湿微生物组(湿度和温度都很高)[12][13],含有大量细菌[14],尤其是棒状杆菌[15]和葡萄球菌[13]等喜欢潮湿环境的细菌。
肚脐生物多样性项目于2011年初在北卡罗来纳州立大学启动,最初有两组志愿者,分别由35名志愿者和25名志愿者组成。[10]志愿者被分配了无菌棉签,并被要求将棉签插入他们的肚脐中,将棉签旋转三圈,然后将棉签放在装有0.5毫升10%磷酸盐缓冲液的小瓶中返回给研究人员。[16][10]由Jiri Hulcr领导的北卡罗来纳州立大学的研究人员[17]随后在培养物中培养样本,直到细菌菌落大到可以拍照,然后将这些照片发布在肚脐生物多样性项目的网站上(志愿者获得样本编号,以便他们可以在线查看自己的样本)。[16]然后使用16S核糖体RNA文库对这些样本进行分析,以便识别在培养物中生长不良的菌株。[10]
北卡罗来纳州立大学的研究人员发现,虽然很难预测肚脐微生物组中的每一种细菌菌株,但他们可以预测哪些菌株会普遍存在,而哪些菌株会非常罕见。[10]结果发现,肚脐微生物组仅包含几种常见的细菌,即葡萄球菌、棒状杆菌、放线菌、真细菌和芽孢杆菌,以及许多不同类型的稀有细菌。[10]在志愿者的肚脐内还发现了其他类型的稀有生物,包括三种古细菌,其中两种是在一名自称多年未洗澡的志愿者身上发现的。[10]
在这个项目的志愿者的肚脐中,葡萄球菌和棒状杆菌是最常见的细菌类型,这些类型的细菌在更大规模的皮肤微生物组研究中[18](肚脐生物多样性项目是其中一部分)也被发现是皮肤微生物组中最常见的细菌类型。[10]在这些更大规模的研究中发现,女性的皮肤微生物组中通常有更多的葡萄球菌[18](通常是表皮葡萄球菌)[16],而男性的皮肤微生物组中则有更多的棒状杆菌。[18]
根据北卡罗来纳州立大学的肚脐生物多样性项目[10],在肚脐和周围区域发现了两种类型的微生物。短暂性细菌(不繁殖的细菌)[12]构成了肚脐中发现的大部分生物,估计在95%的研究参与者中发现了1400多种不同的菌株。[19]
肚脐生物多样性项目正在进行中,现在已经从500多人身上取了样本。[10]该项目的设计旨在反驳一个错误观念,即即细菌总是对人类有害的[20],而人类正在与细菌作战。[21]实际上,即使对人体无益[22],大多数细菌菌株也是无害的。[13]该项目的另一个目标是培养公众对微生物学的兴趣。[17]与人体微生物组计划协作,肚脐生物多样性项目还研究人类微生物组与年龄、性别、种族、地点[17]和整体健康等因素之间的联系。[23]
与宿主的关系
编辑皮肤微生物群落可以是偏利共生的、互利共生的或病原体。通常情况下,它们可以是三者兼备,具体取决于人体免疫系统的强弱。[3]对肠道和肺部免疫系统的研究表明,微生物群落有助于免疫系统的发育,但目前对于皮肤是否也是如此的研究仍在起步阶段。[3]绿脓杆菌是一种可以转化为病原体并引起疾病的互利共生细菌的例子。如果它进入循环系统,就会导致骨骼、关节、胃肠道和呼吸系统感染,而且它还可能引起皮炎。然而,绿脓杆菌也会产生抗微生物物质,例如假单胞菌酸(已被商业开发,例如莫匹罗星),可用于对抗葡萄球菌和链球菌感染。绿脓杆菌还会产生抑制克鲁斯氏念珠菌、白色念珠菌、光滑假丝酵母、酿酒酵母和烟曲霉等真菌生长的物质。[24]它还可以抑制幽门螺杆菌的生长。[25]它的抗菌作用如此重要,以至于人们注意到通过口服或局部使用抗生素去除皮肤中的绿脓杆菌,反而可能会导致异常的酵母菌定植和感染。[3]
另一个细菌方面的问题是体味的生成。汗液本身是无味的,但是一些细菌可以消耗它并产生副产品,这些副产品可能会被人类认为是恶臭的(例如,与苍蝇相反,苍蝇可能会觉得这些气味有吸引力)。以下是一些例子:
皮肤防御
编辑抗微生物肽
编辑皮肤会产生抗微生物肽,例如控制皮肤微生物增殖的抗菌肽。抗菌肽不仅可以直接减少微生物数量,而且还能引起细胞因子的分泌,从而诱发炎症、血管生成和再上皮化。例如,特应性皮炎等病症与抗菌肽产生的抑制有关。[28]而玫瑰痤疮则是由于抗菌肽的异常处理而引起的炎症。银屑病与由抗菌肽产生的自身DNA有关,它导致了自身炎症。控制抗菌肽的一个主要因素是胆钙化醇。[29]
酸度
编辑皮肤的表层自然呈酸性(pH值4至4.5),这是由于汗液中的乳酸和皮肤细菌分泌的乳酸所致。[30]在这种pH值下,共生菌如葡萄球菌、微球菌、棒状杆菌和丙酸杆菌可以生长,但瞬时细菌不会生长,例如革兰氏阴性菌(如埃希氏菌和假单胞菌)或革兰氏阳性菌(如金黄色葡萄球菌)。[30]影响病原菌生长的另一个因素是皮肤分泌的抗菌物质在酸性条件下会得到增强。而在碱性条件下,细菌不再附着在皮肤上,更容易脱落。据观察,皮肤在碱性条件下也会肿胀并张开,使得细菌可以更轻易地移动到表面。[30]
免疫系统
编辑如果被激活,皮肤中的免疫系统会产生针对皮肤癣菌(皮肤真菌)等微生物的细胞介导免疫力。[31]其中一种反应是增加角质层更新,从而使真菌从皮肤表面脱落。皮肤真菌,例如红色毛癣菌,已经进化出创造物质以限制对它们的免疫反应。[31]皮肤脱落是控制皮肤表面菌群积聚的一般手段。[來源請求]
皮肤疾病
编辑微生物在特应性皮炎[32]、酒渣鼻、银屑病[33]和痤疮等非感染性皮肤病中发挥作用[34]受损的皮肤会导致非致病菌变成致病菌。[35]皮肤上物种的多样性与皮炎的后期发展有关。[36]
寻常痤疮
编辑寻常痤疮是一种常见的皮肤病,其特征是毛囊皮脂腺产生过多的皮脂和皮肤发炎。[37]受影响的区域通常被痤疮丙酸杆菌定殖(即使在没有痤疮的人中也是共生微生物群的一员)。[38]高比例的痤疮丙酸杆菌与痤疮有关,但只有某些菌株与痤疮密切相关,而其他菌株则与健康皮肤有关。痤疮丙酸杆菌的相对数量在患有痤疮和没有痤疮的人群之间是相似的。[37][38]
目前的治疗方法包括局部和全身性抗菌药物,可导致丙酸杆菌的定植或活性减少。[39]潜在的益生菌治疗包括使用表皮葡萄球菌来抑制丙酸杆菌的生长。表皮葡萄球菌会产生琥珀酸,已被证明可以抑制痤疮丙酸杆菌的生长。[40]植物乳杆菌也被证明可以起到抗炎作用,并在局部应用时改善皮肤的抗菌性能。植物乳杆菌也被证明可有效减少痤疮病变的大小。[41]
特应性皮炎
编辑患有特应性皮炎的个体在病变和非病变皮肤中都表现出金黄色葡萄球菌数量的增加。[38]特应性皮炎的发作与金黄色葡萄球菌定植导致的低细菌多样性有关,经过标准治疗后,细菌多样性会增加。[來源請求]
目前的治疗包括局部或全身性使用抗生素、皮质类固醇和稀释漂白浴的组合。[42]潜在的益生菌治疗包括使用皮肤共生细菌(表皮葡萄球菌)来抑制金黄色葡萄球菌的生长。在特应性皮炎发作期间,表皮葡萄球菌的种群数量已被证明会增加,以试图控制金黄色葡萄球菌种群。[38][42]
婴儿肠道微生物多样性低与特应性皮炎风险增加有关。[43]患有特应性湿疹的婴儿具有低水平的拟杆菌和高水平的杆菌。拟杆菌具有抗炎特性,这是对抗皮炎所必需的。 [43]
寻常型银屑病
编辑寻常型银屑病通常会影响较干燥的皮肤部位,例如肘部和膝盖。与皮脂腺部位相比,皮肤的干燥区域往往具有较高的微生物多样性和较少的种群数量。[39]一项使用拭子取样技术的研究表明,富含芽孢杆菌(主要是链球菌和葡萄球菌)和放线菌(主要是棒状杆菌和丙酸杆菌)的区域与银屑病有关。[44]而另一项使用活组织检查的研究将增加的杆菌和放线菌水平与健康的皮肤联系起来。而另一项使用活组织检查的研究则将芽孢杆菌和放线菌的水平增加与健康的皮肤联系起来。[45]然而,大多数研究表明,受银屑病影响的个体在受影响区域的微生物多样性较低。
银屑病的治疗包括使用外用药物、光疗和全身药物。[46]目前关于皮肤微生物群落在银屑病中的作用的研究不一致,因此没有潜在的益生菌治疗方法。
酒糟鼻
编辑酒糟鼻通常与皮肤的皮脂腺部位有关。皮螨毛囊蠕形螨会产生脂肪酶,使它们能够将皮脂用作食物来源,因此它们对皮脂腺部位具有很高的亲和力。尽管它是共生皮肤微生物群的一部分,但与健康个体相比,患有酒糟鼻的患者毛囊蠕形螨数量有所增加,这表明其具有致病性。[47]
奥莱龙岛海恩德里克斯氏菌是一种与蠕形螨相关微生物,通常不存在于皮肤共生微生物群中,但它可以启动炎症通路,其启动机制与酒糟鼻患者相似。[38]表皮葡萄球菌种群也曾从酒糟鼻患者的脓疱中分离出来。然而,它们可能被蠕形螨转移到有利于生长的区域,因为蠕形螨已证明可以在面部周围传播细菌。[48]
目前的治疗方法包括局部和口服抗生素以及激光治疗。[49]由于目前的研究尚未显示蠕形螨对酒糟鼻影响的明确机制,因此没有潜在的益生菌治疗方法。
临床
编辑受感染的设备
编辑卫生学
编辑人类皮肤是许多细菌和真菌物种的宿主,其中一些已知是有害的,一些已知是有益的,但绝大多数未经研究。菌和使用杀菌和杀真菌肥皂将不可避免地导致细真菌种群对所使用的化学品产生耐药性。
传染性
编辑皮肤菌群不容易在人与人之间传播。30秒的适度摩擦和干燥的手接触会导致只有0.07%的天然手部菌群从裸体转移,而戴手套则会导致更高的转移比例。[51]
移动
编辑最有效(减少60%至80%)的抗微生物洗涤剂是使用乙醇、异丙醇和正丙醇。高浓度(95%)乙醇对病毒影响最大,而细菌则更容易被正丙醇影响。[52]
不含药物的肥皂不是很有效,以下数据进行了说明。医护人员使用非药物液体肥皂洗手一次,洗手时间为30秒。而学生或技术人员进行了20次洗手。[53]
| 群体和手部皮肤状况 | 未洗过 | 洗过 |
|---|---|---|
| 医护人员身体健康 | 3.47 | 3.15 |
| 医护人员受伤 | 3.33 | 3.29 |
| 学生或技术人员健康 | 4.39 | 3.54 |
| 学生或技术人员受伤 | 4.58 | 4.43 |
洗手的一个重要用途是防止引起医院获得性感染的抗生素耐药性皮肤菌群的传播,例如耐甲氧西林金黄色葡萄球菌。虽然这些菌群由于抗生素而产生了抗药性,但没有证据表明推荐的消毒药水在洗手时会选择抗生素抗性生物。[54]然而,许多微生物菌株对抗菌皂中使用的某些物质(例如三氯生)具有抗药性。[54]
一项调查发现,在牙医诊所的洗手盘中,所有肥皂都有其自己的菌群,并且平均有两到五种不同的微生物属,使用频率更高的肥皂甚至具有更多种类的菌群。[55]对公共厕所中的肥皂进行的另一项调查发现了更多的菌群。[56]还有一项研究发现,非常干燥的肥皂不会被感染,而所有浸泡在水池中的肥皂都被感染了。[57]然而,对被特殊感染的肥皂的研究发现,肥皂菌群不会传播到手上。[58]
受损的皮肤
编辑反复清洗皮肤会破坏保护性外层并导致水分经表皮流失。这可以表现为皮肤粗糙、干燥、瘙痒、由微生物和过敏原穿透角膜层引发的皮炎和红肿。戴手套反而会导致更多问题,因为它会产生有利于微生物生长的潮湿环境,并且还含有乳胶和滑石粉等刺激物。[59]
洗手会损伤皮肤,因为皮肤顶层的角质层由15至20层角蛋白盘、角质细胞组成,每层角质细胞都被一层可以用酒精和清洁剂去除的皮肤脂质薄膜包裹。[60]
破损的皮肤表面广泛裂纹、普遍发红或偶尔出血,这种皮肤更常被人葡萄球菌定植,并且这些细菌更可能对甲氧西林具有耐药性。[59]虽然这与更强的抗生素耐药性无关,但破损的皮肤也更容易被金黄色葡萄球菌、革兰氏阴性菌、肠球菌和念珠菌定植。[59]
与其他菌群的比较
编辑皮肤菌群与肠道菌群不同,肠道菌群主要是芽孢杆菌和拟杆菌。[61]肠道研究中未发现人与人之间存在低水平差异。然而,肠道菌群和皮肤菌群都缺乏土壤菌群中的多样性。[1]
参见
编辑参考文献
编辑- ^ 1.0 1.1 1.2 1.3 Grice EA, Kong HH, Conlan S. Topographical and Temporal Diversity of the Human Skin Microbiome. Science. 2009, 324 (5931): 1190–92. Bibcode:2009Sci...324.1190G. PMC 2805064 . PMID 19478181. doi:10.1126/science.1171700.
- ^ Your Body Is a Wonderland ... of Bacteria. www.science.org. [2023-01-02]. (原始内容存档于2022-12-09) (英语).
- ^ 3.0 3.1 3.2 3.3 3.4 3.5 Cogen AL, Nizet V, Gallo RL. Skin microbiota: a source of disease or defence?. Br J Dermatol. 2008, 158 (3): 442–55. PMC 2746716 . PMID 18275522. doi:10.1111/j.1365-2133.2008.08437.x.
- ^ Voyles, Jamie; Young, Sam; Berger, Lee; Campbell, Craig; Voyles, Wyatt F.; Dinudom, Anuwat; Cook, David; Webb, Rebecca; Alford, Ross A.; Skerratt, Lee F.; Speare, Rick. Pathogenesis of Chytridiomycosis, a Cause of Catastrophic Amphibian Declines. Science. 2009-10-23, 326 (5952): 582–585. Bibcode:2009Sci...326..582V. ISSN 0036-8075. PMID 19900897. S2CID 52850132. doi:10.1126/science.1176765 (英语).
- ^ Grice EA, Kong HH, Renaud G, Young AC, Bouffard GG, Blakesley RW, Wolfsberg TG, Turner ML, Segre JA. A diversity profile of the human skin microbiota. Genome Res. 2008, 18 (7): 1043–50. PMC 2493393 . PMID 18502944. doi:10.1101/gr.075549.107.
- ^ Oyeka CA, Ugwu LO. Fungal flora of human toe webs. Mycoses. 2002, 45 (11–12): 488–91. PMID 12472726. S2CID 8789635. doi:10.1046/j.1439-0507.2002.00796.x.
- ^ Feet home to more than 100 fungi. BBC News. 2013-05-22 [2023-01-02]. (原始内容存档于2023-01-02) (英国英语).
- ^ Ecological Society of America. Bellybutton microbiomes: Ecological research on the human biome (Press Release). ScienceDaily. 2011-08-04 [2013-04-20]. (原始内容存档于2023-07-22).
- ^ Nierenberg, Cari. New meaning to 'navel-gazing': Scientists study belly button bacteria. 2011-04-14 [2013-09-29]. (原始内容存档于2023-03-18).
- ^ 10.00 10.01 10.02 10.03 10.04 10.05 10.06 10.07 10.08 10.09 Hulcr, Jirir; Andrew M. Latimer; Jessica B. Henley; Nina R. Rountree; Noah Fierer; Andrea Lucky; Margaret D. Lowman; Robert R. Dunn. A Jungle in There: Bacteria in Belly Buttons are Highly Diverse, but Predictable. PLOS ONE. 7 November 2012, 7 (11): e47712. Bibcode:2012PLoSO...747712H. PMC 3492386 . PMID 23144827. doi:10.1371/journal.pone.0047712 .
- ^ The Wild Life of Your Body. [1 September 2013]. (原始内容存档于2014-08-10).
- ^ 12.0 12.1 Kong, Hiedi. Skin microbiome: genomics-based insights into the diversity and role of skin microbes. Trends Mol. Med. June 17, 2011, 17 (6): 320–8. PMC 3115422 . PMID 21376666. doi:10.1016/j.molmed.2011.01.013.
- ^ 13.0 13.1 13.2 Grice, Elizabeth; Julia Segre. The Skin Microbiome. Nat Rev Microbiol. 9 April 2011, 9 (4): 244–53. PMC 3535073 . PMID 21407241. doi:10.1038/nrmicro2537.
- ^ Kaplan, Karen. Study shows you're covered in bacteria - live with it.. The Star. 1 June 2009 [29 September 2013]. (原始内容存档于11 November 2013).
- ^ Grice, Elizabeth; Heidi H. Kong; Sean Conlan; Clayton B. Deming; Joie Davis; Alice C. Young; Gerard G. Bouffard; Robert W. Blakesley; Patrick R. Murray; Eric D. Green; Maria L. Turner; Julia A. Segre. Topographical and Temporal Diversity of the Human Skin Microbiome. Science. 29 May 2009, 324 (5931): 1190–2. Bibcode:2009Sci...324.1190G. PMC 2805064 . PMID 19478181. doi:10.1126/science.1171700.
- ^ 16.0 16.1 16.2 Parker-Pope, Tara. What's in Your Belly Button. 2011-04-14 [2013-09-29]. (原始内容存档于2021-03-08).
- ^ 17.0 17.1 17.2 Nierenberg, Cari. New meaning to 'navel-gazing': Scientists study Belly Button Bacteria. NBC News. [2013-09-29]. (原始内容存档于2023-03-18).
- ^ 18.0 18.1 18.2 Callewaert, Chris; Frederiek-Maarten Kerckhof; Michael S. Granitsiotis; Mireille Van Gele; Tom Van de Wiele; Nico Boon. Characterization of Staphylococcus and Corynebacterium Clusters in the Human Axillary Region. PLOS ONE. 12 August 2013, 8 (8): e70538. Bibcode:2013PLoSO...870538C. PMC 3741381 . PMID 23950955. doi:10.1371/journal.pone.0070538 .
- ^ Saunders, Chris. Navel gazing at NC State leads to important discovery. Red & White for Life :: NC State University Alumni Association. 2011-07-12 [2013-04-20]. (原始内容存档于2016-12-14).
- ^ Aldhous, Peter. Belly button biome is more than a piece of fluff. [2013-09-29]. (原始内容存档于2013-10-02).
- ^ Human microbes. [2013-09-29]. (原始内容存档于2023-06-13).
- ^ Ahmad, Salar; Shailly Anand; Rup Lal. Skin Commensals Regulate Skin Immunity. Indian J. Microbiol. September 2012, 52 (3): 517–8. PMC 3460106 . PMID 23997352. doi:10.1007/s12088-012-0301-z.
- ^ Grice, Elizabeth; Julia Segre. The Human Microbiome: Our Second Genome. Annu Rev Genom Hum Genet. 6 June 2012, 13 (1): 151–70. PMC 3518434 . PMID 22703178. doi:10.1146/annurev-genom-090711-163814.
- ^ Kerr JR. Suppression of fungal growth exhibited by Pseudomonas aeruginosa. J Clin Microbiol. 1994, 32 (2): 525–7. PMC 263067 . PMID 8150966. doi:10.1128/JCM.32.2.525-527.1994.
- ^ Krausse R, Piening K, Ullmann U. Inhibitory effects of various micro-organisms on the growth of Helicobacter pylori. Lett Appl Microbiol. 2005, 40 (1): 81–6. PMID 15613007. S2CID 2253604. doi:10.1111/j.1472-765X.2004.01632.x .
- ^ Ara K, Hama M, Akiba S, et al. Foot odor due to microbial metabolism and its control. Can. J. Microbiol. 2006, 52 (4): 357–64. PMID 16699586. S2CID 36221022. doi:10.1139/w05-130.
- ^ Ara K, Hama M, Akiba S, Koike K, Okisaka K, Hagura T, Kamiya T, Tomita F. Foot odor due to microbial metabolism and its control. Can J Microbiol. 2006, 52 (4): 357–64. PMID 16699586. doi:10.1139/w05-130.[失效連結]
- ^ Patra, Vijaykumar; Mayer, Gerlinde; Gruber-Wackernagel, Alexandra; Horn, Michael; Lembo, Serena; Wolf, Peter. Unique profile of antimicrobial peptide expression in polymorphic light eruption lesions compared to healthy skin, atopic dermatitis, and psoriasis. Photodermatology, Photoimmunology & Photomedicine. 2018, 34 (2): 137–144. PMC 5888155 . PMID 29044786. doi:10.1111/phpp.12355.
- ^ Schauber J, Gallo RL. Antimicrobial peptides and the skin immune defense system. J Allergy Clin Immunol. 2008, 122 (2): 261–6. PMC 2639779 . PMID 18439663. doi:10.1016/j.jaci.2008.03.027.
- ^ 30.0 30.1 30.2 Lambers H, Piessens S, Bloem A, Pronk H, Finkel P. Natural skin surface pH is on average below 5, which is beneficial for its resident flora. International Journal of Cosmetic Science. 2006, 28 (5): 359–70. PMID 18489300. S2CID 25191984. doi:10.1111/j.1467-2494.2006.00344.x.
- ^ 31.0 31.1 Dahl MV. Suppression of immunity and inflammation by products produced by dermatophytes. J Am Acad Dermatol. 1993, 28 (5 Pt 1): S19–S23. PMID 8496406. doi:10.1016/s0190-9622(09)80303-4.
- ^ Baker BS. The role of microorganisms in atopic dermatitis. Clin Exp Immunol. 2006, 144 (1): 1–9. PMC 1809642 . PMID 16542358. doi:10.1111/j.1365-2249.2005.02980.x.
- ^ Paulino LC, Tseng CH, Strober BE, Blaser MJ. Molecular analysis of fungal microbiota in samples from healthy human skin and psoriatic lesions. J Clin Microbiol. 2006, 44 (8): 2933–41. PMC 1594634 . PMID 16891514. doi:10.1128/JCM.00785-06.
- ^ Holland KT, Cunliffe WJ, Roberts CD. Acne vulgaris: an investigation into the number of anaerobic diphtheroids and members of the Micrococcaceae in normal and acne skin. Br J Dermatol. 1977, 96 (6): 623–6. PMID 141301. S2CID 37507292. doi:10.1111/j.1365-2133.1977.tb05206.x.
- ^ Roth RR, James WD. Microbial ecology of the skin. Annu Rev Microbiol. 1988, 42 (1): 441–64. PMID 3144238. doi:10.1146/annurev.mi.42.100188.002301.
- ^ Williams, Michael R.; Gallo, Richard L. Evidence that Human Skin Microbiome Dysbiosis Promotes Atopic Dermatitis. Journal of Investigative Dermatology. 2017, 137 (12): 2460–2461. PMC 5814121 . PMID 29169458. doi:10.1016/j.jid.2017.09.010.
- ^ 37.0 37.1 Fitz-Gibbon, S; Shuta, T; Bor-Han, C; Nguyen, L; Du, C; Minghsun, L; Elashoff, D; Erfe, MC; Loncaric, A; Kim, J; Modlin, RL; Miller, JF; Sodergren, E; Craft, N; Weinstock, GM; Li, H. Propionibacterium acnes Strain Populations in the Human Skin Microbiome Associated with Acne. J Invest Dermatol. 2013, 133 (9): 2152–2160. PMC 3745799 . PMID 23337890. doi:10.1038/jid.2013.21.
- ^ 38.0 38.1 38.2 38.3 38.4 Grice, EA. The skin microbiome: potential for novel diagnostic and therapeutic approaches to cutaneous disease. Semin Cutan Med Surg. 2014, 33 (2): 98–103. PMC 4425451 . PMID 25085669. doi:10.12788/j.sder.0087. (原始内容存档于2015-04-11).
- ^ 39.0 39.1 Hannigan, GD; Grice, EA. Microbial ecology of the skin in the era of metagenomics and molecular microbiology. Cold Spring Harb Perspect Med. 2013, 3 (12): a015362. PMC 3839604 . PMID 24296350. doi:10.1101/cshperspect.a015362.
- ^ Muya, S; Wang, Y; Yu, J; Kuo, S; Coda, A; Jiang, Y; Gallo, RL; Huang, CM. Fermentation of Propionibacterium acnes, a Commensal Bacterium in the Human Skin Microbiome, as Skin Probiotics against Methicillin-Resistant Staphylococcus aureus. PLOS ONE. 2013, 8 (2): e55380. Bibcode:2013PLoSO...855380S. PMC 3566139 . PMID 23405142. doi:10.1371/journal.pone.0055380 .
- ^ Muizzuddin, N; Maher, W; Sullivan, M; Schnittger, S; Mammone, T. Physiological effect of probiotic on skin.. J Cosmet Sci. 2012, 63 (6): 385–95. PMID 23286870.
- ^ 42.0 42.1 Kong, HH; Oh, J; Deming, C; Conlan, S; Grice, EA; Beatson, MA; Nomicos, E; Polley, EC; Komarow, HD; NISC Comparative Sequence Program; Murray, PR; Turner, ML; Segre, JA. Temporal shifts in the skin microbiome associated with disease flares and treatment in children with atopic dermatitis. Genome Res. 2012, 22 (5): 850–9. PMC 3337431 . PMID 22310478. doi:10.1101/gr.131029.111.
- ^ 43.0 43.1 Abrahamsson, TR; Jakobsson, HE; Andersson, AF; Björkstén, B; Engstrand, L; Jenmalm, MC. Low diversity of the gut microbiota in infants with atopic eczema. J Allergy Clin Immunol. 2012, 129 (2): 434–40, 440.e1–2. PMID 22153774. doi:10.1016/j.jaci.2011.10.025.
- ^ Alekseyenko, AV; Perez-Perez, GI; De Souza, A; Strober, B; Gao, Z; Bihan, M; Li, K; Methé, BA; Blaser, MJ. Community differentiation of the cutaneous microbiota in psoriasis. Microbiome. 2013, 1 (1): 31. PMC 4177411 . PMID 24451201. doi:10.1186/2049-2618-1-31.
- ^ Fahlén, A; Engstrand, L; Baker, BS; Powles, A; Fry, L. Comparison of bacterial microbiota in skin biopsies from normal and psoriatic skin.. Arch Dermatol Res. 2012, 304 (1): 15–22. PMID 22065152. S2CID 9169314. doi:10.1007/s00403-011-1189-x.
- ^ Menter, A; Griffiths, CE. Current and future management of psoriasis.. Lancet. 2007, 370 (9583): 272–84. PMID 17658398. S2CID 7907468. doi:10.1016/S0140-6736(07)61129-5.
- ^ Casas, C; Paul, C; Lahfa, M; Livideanu, B; Lejeune, O; Alvarez-Georges, S; Saint-Martory, C; Degouy, A; Mengeaud, V; Ginisty, H; Durbise, E; Schmitt, AM; Redoulès, D. Quantification of Demodex folliculorum by PCR in rosacea and its relationship to skin innate immune activation.. Exp Dermatol. 2012, 21 (12): 906–10. PMID 23171449. S2CID 19722615. doi:10.1111/exd.12030.
- ^ Jarmuda, S; O'Reilly, N; Zaba, R; Jakubowicz, O; Szkaradkiewicz, A; Kavanagh, K. Potential role of Demodex mites and bacteria in the induction of rosacea.. J Med Microbiol. 2012, 61 (Pt 11): 1504–10. PMID 22933353. doi:10.1099/jmm.0.048090-0 .
- ^ Cohen, AF; Tiemstra, JD. Diagnosis and treatment of rosacea. J Am Board Fam Pract. 2002, 15 (3): 214–7. PMID 12038728.
- ^ Martín-Rabadán P, Gijón P, Alcalá L, Rodríguez-Créixems M, Alvarado N, Bouza E. Propionibacterium acnes is a common colonizer of intravascular catheters. J Infect. 2008, 56 (4): 257–60. PMID 18336916. doi:10.1016/j.jinf.2008.01.012.
- ^ Lingaas E, Fagernes M. Development of a method to measure bacterial transfer from hands. J Hosp Infect. 2009, 72 (1): 43–9. PMID 19282052. doi:10.1016/j.jhin.2009.01.022.
- ^ Kampf G, Kramer A. Epidemiologic background of hand hygiene and evaluation of the most important agents for scrubs and rubs. Clin Microbiol Rev. 2004, 17 (4): 863–93. PMC 523567 . PMID 15489352. doi:10.1128/CMR.17.4.863-893.2004.
- ^ Borges LF, Silva BL, Gontijo Filho PP. Hand washing: changes in the skin flora. Am J Infect Control. 2007, 35 (6): 417–20. PMID 17660014. doi:10.1016/j.ajic.2006.07.012.
- ^ 54.0 54.1 Weber DJ, Rutala WA. Use of germicides in the home and the healthcare setting: is there a relationship between germicide use and antibiotic resistance?. Infect Control Hosp Epidemiol. 2006, 27 (10): 1107–19. PMID 17006819. S2CID 20734025. doi:10.1086/507964.
- ^ Hegde PP, Andrade AT, Bhat K. Microbial contamination of "in use" bar soap in dental clinics. Indian J Dent Res. 2006, 17 (2): 70–3. PMID 17051871. doi:10.4103/0970-9290.29888.
- ^ Kabara JJ, Brady MB. Contamination of bar soaps under "in-use" conditions. J Environ Pathol Toxicol Oncol. 1984, 5 (4–5): 1–14. PMID 6394740.
- ^ Afolabi BA, Oduyebo OO, Ogunsola FT. Bacterial flora of commonly used soaps in three hospitals in Nigeria. East Afr Med J. 2007, 84 (10): 489–95. PMID 18232270. doi:10.4314/eamj.v84i10.9567 .
- ^ Heinze JE, Yackovich F. Washing with contaminated bar soap is unlikely to transfer bacteria. Epidemiol Infect. 1988, 101 (1): 135–42. PMC 2249330 . PMID 3402545. doi:10.1017/s0950268800029290.
- ^ 59.0 59.1 59.2 Larson EL, Hughes CA, Pyrek JD, Sparks SM, Cagatay EU, Bartkus JM. Changes in bacterial flora associated with skin damage on hands of health care personnel. Am J Infect Control. 1998, 26 (5): 513–21. PMID 9795681. doi:10.1016/s0196-6553(98)70025-2 .
- ^ Kownatzki E. Hand hygiene and skin health. J Hosp Infect. 2003, 55 (4): 239–45. PMID 14629966. doi:10.1016/j.jhin.2003.08.018.
- ^ Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, Gill SR, Nelson KE, Relman DA. Diversity of the human intestinal microbial flora. Science. 2005, 308 (5728): 1635–8. Bibcode:2005Sci...308.1635E. PMC 1395357 . PMID 15831718. doi:10.1126/science.1110591.