囊肿性纤维化
囊肿性纤维化(英语:cystic fibrosis,缩写作 CF),亦称为囊性纤维化、囊肿性纤维变性、囊肿纤维症、纤维性囊肿或囊纤维变性,是一种遗传疾病,此病症最常影响肺脏,但也常发生于胰脏、肝脏、肾脏,以及肠[1][2]。长期影响包含肺部感染所导致的呼吸困难以及积痰,其他可能的症状包括鼻窦炎、发育不良、油便、手脚指甲杵状膨大、男性不孕,以及其他症状。每个人的症状不尽相同[1]。 囊肿性纤维化为体染色体隐性遗传疾病[3],发生突变的结果在230 kb的基因,基因位于染色体7q31,要在两条囊性纤维化跨膜调节器(CFTR)等位基因的突变时才会发病[1]。只有一个突变基因的人是带因者(carriers),通常没有任何显著症状[4]。CFTR与汗液、消化液、体液和黏液分泌有关[5]。当CFTR失去功能时,原先分泌较少的位置分泌量会增加[6]。诊断方面可利用发汗试验和基因检测进行[1],有些地区会对此疾病进行新生儿筛检[1]。 目前尚无可治愈囊肿性纤维化的疗法[4],若是肺部感染,则多以抗生素进行治疗,给予方法可分为静脉注射、吸入器或口服,有时会长期使用像阿奇霉素之类的长效型抗生素,喷雾吸入型的有高张食盐水和沙丁胺醇也非常有效。如果肺部功能持续恶化,则优先考虑进行肺移植。胰脂肪酶以及脂溶性维生素的支持疗法对于年轻患者来说是相当重要的,许多病患使用像是胸腔物理治疗的呼吸道清除技术来对抗囊肿性纤维化,然而目前仍没有足够的证据支持疗效[1]。在发达国家,囊肿性纤维化的患者平均寿命约在42到50岁[7][8],有80%的肺疾患者是因为囊肿性纤维化而死亡[1]。 囊肿性纤维化常见于拥有北欧血统的人,约每2500位新生儿中就有1人患病[1]大约25人里会有1人为带因者[4],阿什肯纳兹犹太人也常出现这类的疾病。而在非裔与亚裔人口中较为罕见[1]。本疾病最早的纪录可以追溯至1595年,但一直到1938年,桃乐丝·安得森才首次将囊肿性纤维化定义为一种疾病[2]。1989年时由分子遗传学家徐立之教授成功发现囊胞状纤维症的病因。囊肿性纤维化的英文cystic fibrosis讲述的是发生在胰脏的纤维化与囊肿[2][3]。
| 囊肿性纤维化 | |
|---|---|
| 又称 | mucoviscidosis |
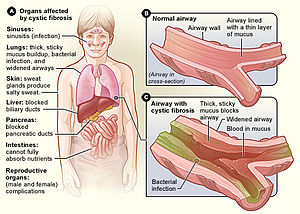 | |
| 图 A 显示了囊性纤维化可能影响的器官。 图 B 显示了正常器官的横截面。 图 C 显示了囊性纤维化的器官。 加宽的气管被含有血液和细菌的黏稠黏液堵塞。 | |
| 症状 | 肠阻塞、骨质疏松症、胃及十二指肠溃疡、胆汁淤积[*]、肝炎、胆石症[*]、肝硬化、支气管炎、肺炎、肺不张[*]、支气管扩张、肺纤维化、肌肉无力[*]、呼吸困难、发绀、心衰竭 |
| 类型 | 常染色体隐性遗传病[*]、肺病[*]、genetic biliary tract disease[*]、genetic pancreatic disease[*]、rare genetic respiratory disease[*]、rare male fertility disorder with obstructive azoospermia[*]、rare genetic disorder with obstructive azoospermia[*]、症候群、疾病 |
| 诊断方法 | 体格检查、发汗试验[*]、筛检 |
| 分类和外部资源 | |
| 医学专科 | 医学遗传学、胸腔医学 |
| ICD-11 | CA25 |
| ICD-10 | E84 |
| ICD-9-CM | 277.0 |
| OMIM | 219700 |
| DiseasesDB | 3347 |
| MedlinePlus | 000107 |
| eMedicine | 1001602 |
| Orphanet | 586 |
症状
编辑囊肿性纤维化症的症状可以因为患者的年龄、体内器官受影响的程度、以前的治疗以及被其他不同病症感染而有差异。总而言之,囊肿性纤维化有全身性的影响,其中包括成长方面、呼吸方面、消化系统方面、以及性器官方面。带有囊肿性纤维化症的新生儿会有缓慢的成长率以及肠阻塞的问题,随着患者的成长,其他症状随之出现,其中包括长期性的发育不良、频繁的肺部感染、消化吸收的困难、以及导致不孕症。
肺部及呼吸道感染
编辑囊肿性纤维化所产生的浓稠黏液会阻塞细小的气管,这些粘液在肺部成为细菌繁殖的场所,使得肺部反复受感染发炎而导致肺部组织的变化。早期的症状包括不断的咳嗽、大量的咳痰、以及运动量的减少都很常见。到了后期时,肺部组织的变化导致长期的呼吸困难。
其他症状包括咳血(hemoptysis)、支气管扩张(bronchiectasis)、肺血管高血压(pulmonary hypertension)、心脏衰竭、循环系统运送氧气效率的减低、以及呼吸器官的衰竭[9]。早期最常见的细菌感染源为金黄色葡萄球菌 (Staphylococcus aureus) 和流感嗜血杆菌 (Haemophilus influenzae); 绿脓杆菌(Pseudomonas aeruginosa)和洋葱伯克氏菌(Burkholderia cepacia)次之。 除了细菌感染之外,患者常会产生其他与肺部有关的症状,其中包括过敏性支气管肺麹菌症(allergic bronchopulmonary aspergillosis),这是一种患者身体对一种常见的霉菌烟曲霉(Aspergillus fumigatus)产生不良反应,导致严重的呼吸困难,另外还有鸟型分枝杆菌(mycobacterium avium complex)是一种与肺结核菌相当类似的细菌,它会对肺部组织产生更进一步的感染,而且大部分的抗生素对此种细菌都没有效果。
鼻窦内的浓稠黏液也会阻塞鼻窦而导致感染,症状包括脸部疼痛、发烧以及头痛。由于长时间的反复发炎,囊肿性纤维化患者的鼻腔内会有鼻肉增生的情况,这些鼻息肉会阻碍呼吸道进而引起呼吸困难。[10][11]
消化道、肝脏、及胰脏方面
编辑在诊断一个患有囊肿性纤维化的新生儿时候可以观察其排胎便的能力,如果一个新生儿不能成功的排便的话,那就可以诊断出该婴儿患有囊肿性纤维化。不能排出的胎便可能完全的堵住婴儿的肠道,这种症状有十分之一的机会会发生在患有囊肿性纤维化的新生儿的身上。[12]由于堆积了大量的粪便,肠道穿孔也很常见,其他包括营养不良、及咳嗽时腹压大幅增加。[13]
除了肺脏会累积黏液之外,负责分泌胰液的胰脏同样也会累积浓稠的分泌物。这些过于浓稠的黏液会阻挡胰脏消化液进入肠道的管道,而这些堆积在胰脏内的消化液便会引起胰脏炎,进一步的对胰脏产生难以复原的伤害。[14]除了对胰脏产生的损害之外,消化道内也会因为缺乏胰脏的消化液而导致难以消化及吸收食物营养素,这会导致营养不良以及发育不良,许多人体需要的营养素以及维生素都无法取得,例如维生素A、D、E、及K等脂溶性维生素,除了胰脏的问题之外,患者也常会有胃食道逆流、肠套叠导致的肠道阻塞、以及便秘等[15],而年长的患者则可能会另有与胎儿肠道阻塞相似的大肠阻塞症。[16]
同样受到浓稠的消化液分泌物影响的器官还有肝脏。由肝脏分泌以帮助消化脂肪的胆汁会堵塞胆管,进而对肝脏产生损坏。长时间下来,可能会导致肝硬化使得肝脏失去去除身体内毒素以及制造重要蛋白质,例如凝血因子等,的能力。[17]
内分泌疾病及成长发育方面
编辑当胰脏受损时,其内部负责分泌胰岛素的胰岛细胞也有可能会遭受损坏而死亡,进而导致糖尿病[18]。受影响的肠道吸收能力容易导致营养不良,例如对调节骨骼发育基本营养的钙与磷非常重要的维生素D如果吸收不良的话,可能会导致骨质疏松使得病患容易骨折[19]。除此之外,在患者身上也可常见手指脚趾肿大的症状,这是因为此慢性病的影响以及末梢骨骼长期缺氧的结果。
另一非常常见的症状是发育不良。患此症的儿童通常会比同年龄的儿童成长缓慢许多,而通常囊肿性纤维化也是在诊断发育不良时才会被发现。此病症的许多原因都可以造成发育不良,例如长期的肺部感染、营养吸收不良、或是过快的新陈代谢率等都可能造成发育不良。
不孕
编辑男性与女性都会受此病的影响而导致不孕不育,而根据统计,97%的男性患者是完全不育的[20],这是因为虽然男性患者是可以正常的产生精子,但是生理上却缺少连接睾丸与外界的输精管,所以正常且健康的精子不存在于自然射精的精液中[21]。因此,许多因缺乏输精管而不孕的男性在经过人工受孕的过程中可被诊断出之前未被发现的轻微囊肿性纤维化症状[22]。囊肿性纤维化女性患者的生育能力较男性患者受到影响更小,相当一部分女性患者仍有正常生育能力;但是囊肿性纤维化显著提高了怀孕的风险。在患有囊肿性纤维化的女性中,有20%是因为过于浓厚的子宫颈黏液而导致的不孕,因为过于浓厚的黏液会妨碍精子的前进。有时候不孕症状也可能是由于营养不良所导致的不正常排卵或停经所产生的。[23]
流行病学
编辑囊性纤维化是欧洲人中最常见、无法治愈且缩短寿命的体染色体隐性遗传疾病。[24] 在美国,大约有 3 万人患有 CF; 大多数是在六个月大时被诊断出来的。 在加拿大,大约有 4,000 人患有 CF。 [25] 大约每 25 名欧洲人后裔中就有 1 人以及每 30 名美国白人中就有 1 人[26] 是 CF 突变的带原者。 尽管CF 在这些群体中不太常见,但大约四分之一的拉丁美洲人、六十五分之一的非洲人和九十分之一的亚洲人携带至少一种异常CFTR 基因。[27][28] 爱尔兰是世界上 CF 盛行率最高的国家,为 1353 分之一。[29] 虽然CF 是一种罕见疾病,但它被列为最普遍的缩短寿命的遗传性疾病之一。 它在西方世界的国家中最为常见。
在亚洲,不同国家囊性纤维化的发生率估计为万分之一到四万分之一(1/40,750)。 在中国,这个比例可能是六万四千分之一。 在亚洲,它常常被低估,原因有几个:突变通常是非典型的或不同于白人,获得汗液测试和临床 CFTR 基因组的机会非常有限,而且医疗专业人员对于此疾病的认识普遍较低。[30]
诊断、生活品质及治疗
编辑已怀孕或是准备要怀孕的夫妻可以经由检查CFTR基因是否有突变来判断胎儿得到囊肿性纤维化的几率,若单个或两个夫妻测出的结果都是高危险群,那么便再测试婴儿的CFTR基因。[31]
诊断囊肿性纤维化的方法包括新生儿检验、汗液氯钠电解质浓度检验、以及基因检验等测试方法。目前(1997年)在美国国内,有10%的患者是在出生后马上进行的新生儿检验时被诊断出患有囊肿性纤维化的病症,在这些婴儿的体内都有一致的胰蛋白酶(Trypsin)过高的检验结果。由于在许多地方囊肿性纤维化的检验并不是例行的新生儿检验的一部分,因此大部分的患者都是在囊肿性纤维化的症状出现后才就医发现患有此病。在对非新生儿做测试时,最常用的检验方法是汗液检验法;受试者会被接上电极连接到测试仪器以及被刺激排汗,这个过程称为离子导入法(Iontophoresis),之后测试人员会对收集到的受试者的汗液进行汗液中钠与氯的含量测验,而汗液中含有过高的钠氯含量则代表该受试者患有囊肿性纤维化病症。除了汗液检验法之外,基因检验法也可以由确认CFTR基因是否有突变来诊断。[32]
许多不同的检测方法可以检验及追踪囊肿性纤维化的并发症的发展,例如X光片及电脑断层扫描可以用来检查肺部是否有任何组织损坏或是感染,唾液检验可以得知感染的细菌种类,肺活量测试测验肺功能,验血可以得知肝功能、维他命缺乏症、及糖尿病,双能量X光骨质密度仪(Dual energy X-ray absorptiometry, DEXA scans)则可以检验骨质疏松症,而粪便检验可以帮助诊断消化酵素缺乏症。
预后
编辑由于透过筛检进行早期诊断、更好的治疗和获得医疗保健,囊性纤维化的预后有所改善。 1959年,美国CF儿童的中位存活年龄为六个月。[33] 2010 年,女性的存活期估计为 37 年,男性的存活期为 40 年。[34] 在加拿大,中位存活期从 1982 年的 24 岁增加到 2007 年的 47.7 岁。[35] 在美国,2016 年出生的 CF 患者在专科诊所接受护理后,预期寿命为 47.7 岁。[36]
目前还没有明确的治疗CF 的方法,但可以使用多种药物,例如粘液溶解剂、支气管扩张剂、类固醇和抗生素,其目的分别是松弛粘液、扩张气道、减少炎症和对抗肺部感染。 [37] CFTR 调节剂以突变的 CFTR 蛋白为目标。[27][28] 迄今为止,已有一些经批准的针对特定突变的 CFTR 调节剂。[38][39]近年来,出现了新类别的调制器,都算孤儿药:Trikafta®(elexacaftor/tezacaftor/ivacaftor) ,Symdeko®(tezacaftor/ivacaftor),Orkambi®(lumacaftor/ivacaftor),Kalydeco® (ivacaftor)。[40]
生活品质
编辑慢性病可能很难控制。 CF 是一种慢性疾病,影响“消化道和呼吸道,导致全身营养不良和慢性呼吸道感染”。[41] 黏稠的分泌物阻塞肺部气道,常引起发炎和严重的肺部感染。[42][43] 如果它受到损害,就会影响 CF 患者的生活品质以及他们完成日常家务等任务的能力。 有很多方法可以提高 CF 患者的生活品质。 促进运动以增强肺功能。 将运动计划纳入 CF 患者的日常生活中可以显著改善生活品质。[44] 新型组合药物可能会显著改善生活。
参考文献
编辑- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 O'Sullivan, BP; Freedman, SD. Cystic fibrosis.. Lancet. 30 May 2009, 373 (9678): 1891–904. PMID 19403164. doi:10.1016/s0140-6736(09)60327-5.
- ^ 2.0 2.1 2.2 Hodson, Margaret; Geddes, Duncan; Bush, Andrew (编). Cystic fibrosis 3rd. London: Hodder Arnold. 2012: 3 [2016-04-02]. ISBN 978-1-4441-1369-3. (原始内容存档于2016-03-05).
- ^ 3.0 3.1 Andersen DH. Cystic fibrosis of the pancreas and its relation to celiac disease: a clinical and pathological study. Am J Dis Child. 1938, 56: 344–399. doi:10.1001/archpedi.1938.01980140114013.
- ^ 4.0 4.1 4.2 Massie, J; Delatycki, MB. Cystic fibrosis carrier screening.. Paediatric respiratory reviews. December 2013, 14 (4): 270–5. PMID 23466339. doi:10.1016/j.prrv.2012.12.002.
- ^ Buckingham, Lela. Molecular diagnostics fundamentals, methods, and clinical applications 2nd. Philadelphia: F.A. Davis Co. 2012: 351 [2016-04-02]. ISBN 978-0-8036-2975-2. (原始内容存档于2016-03-04).
- ^ Yankaskas JR, Marshall BC, Sufian B, Simon RH, Rodman D. Cystic fibrosis adult care consensus conference report. Chest. 2004, 125 (90010): 1–39. PMID 14734689. doi:10.1378/chest.125.1_suppl.1S.[失效链接]
- ^ Ong, T; Ramsey, BW. Update in Cystic Fibrosis 2014.. American Journal of Respiratory and Critical Care Medicine. 15 September 2015, 192 (6): 669–75. PMID 26371812. doi:10.1164/rccm.201504-0656UP.
- ^ Nazareth, D; Walshaw, M. Coming of age in cystic fibrosis - transition from paediatric to adult care.. Clinical medicine (London, England). October 2013, 13 (5): 482–6. PMID 24115706. doi:10.7861/clinmedicine.13-5-482.
- ^ Rowe SM, Miller S, Sorscher EJ. Cystic fibrosis. N Engl J Med. 2005 May 12;352(19):1992-2001. PMID 15888700
- ^ Maldonado M, Martinez A, Alobid I, Mullol J. The antrochoanal polyp. Rhinology. 2004 Dec;42(4):178-82. Review. PMID 15626248
- ^ Ramsey B, Richardson MA. Impact of sinusitis in cystic fibrosis. Allergy Clin Immunol. 1992 Sep;90(3 Pt 2):547-52. PMID 1527348
- ^ Eggermont E, De Boeck K. Small-intestinal abnormalities in cystic fibrosis patients. Eur J Pediatr. 1991 Oct;150(12):824-8. Review. PMID 1743211
- ^ Kulczycki LL, Shwachman H. Studies in cystic fibrosis of the pancreas; occurrence of rectal prolapse. N Engl J Med. 1958 Aug 28;259(9):409-12. PMID 13578072
- ^ Cohn JA, Friedman KJ, Noone PG, Knowles MR, Silverman LM, Jowell PS. Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis. N Engl J Med. 1998 Sep 3;339(10):653-8. PMID 9725922
- ^ Malfroot A, Dab I. New insights on gastro-oesophageal reflux in cystic fibrosis by longitudinal follow up. Arch Dis Child. 1991 Nov;66(11):1339-45. PMID 175564
- ^ Khoshoo V, Udall JN Jr. Meconium ileus equivalent in children and adults. Am J Gastroenterol. 1994 Feb;89(2):153-7. PMID 8304294
- ^ Williams SG, Westaby D, Tanner MS, Mowat AP. Liver and biliary problems in cystic fibrosis. Br Med Bull. 1992 Oct;48(4):877-92. PMID 1458306
- ^ Moran A, Pyzdrowski KL, Weinreb J, Kahn BB, Smith SA, Adams KS, Seaquist ER.Insulin sensitivity in cystic fibrosis. Diabetes. 1994 Aug;43(8):1020-6. PMID 8039595
- ^ Haworth CS, Selby PL, Webb AK, Dodd ME, Musson H, McL Niven R, Economou G, Horrocks AW, Freemont AJ, Mawer EB, Adams JE. Low bone mineral density in adults with cystic fibrosis. Thorax. 1999 Nov;54(11):961-7. PMID 10525552
- ^ McCallum TJ, Milunsky JM, Cunningham DL, Harris DH, Maher TA, Oates RD. Fertility in men with cystic fibrosis: an update on current surgical practices and outcomes. Chest. 2000 Oct;118(4):1059-62. PMID 11035677
- ^ Dodge JA. Male fertility in cystic fibrosis. Lancet. 1995 Sep 2;346(8975):587-8. PMID 7650999
- ^ Augarten A, Yahav Y, Kerem B, Halle D, Laufer J, Szeinberg A, Dor J, Mashiach S, Gazit E, Madgar I. Congenital bilateral absence of vas deferens in the absence of cystic fibrosis. Lancet 344: 1473-1474, 1994. PMID 7968122
- ^ Gilljam M, Antoniou M, Shin J, Dupuis A, Corey M, Tullis DE. Pregnancy in cystic fibrosis. Fetal and maternal outcome. Chest. 2000 Jul;118(1):85-91. PMID 10893364
- ^ Tobias E. Essential Medical Genetics. John Wiley & Sons. 2011: 312. ISBN 978-1-118-29370-6. (原始内容存档于2016-04-17).
- ^ The Canadian Facts & Figures on Cystic Fibrosis. cysticfibrosis.ca. (原始内容存档于2013-06-16).
- ^ Genetic Carrier Testing. Cystic Fibrosis Foundation. 2007. (原始内容存档于2010-03-23).
- ^ Rosenstein BJ, Cutting GR. The diagnosis of cystic fibrosis: a consensus statement. Cystic Fibrosis Foundation Consensus Panel. The Journal of Pediatrics. April 1998, 132 (4): 589–95. PMID 9580754. doi:10.1016/S0022-3476(98)70344-0.
- ^ Hamosh A, FitzSimmons SC, Macek M, Knowles MR, Rosenstein BJ, Cutting GR. Comparison of the clinical manifestations of cystic fibrosis in black and white patients. The Journal of Pediatrics. February 1998, 132 (2): 255–9. PMID 9506637. doi:10.1016/S0022-3476(98)70441-X .
- ^ Farrell P, Joffe S, Foley L, Canny GJ, Mayne P, Rosenberg M. Diagnosis of cystic fibrosis in the Republic of Ireland: epidemiology and costs. Irish Medical Journal. September 2007, 100 (8): 557–60. PMID 17955689. (原始内容存档于2013-12-03).
- ^ Xiaobei Guo; et al. Clinical and genetic characteristics of cystic fibrosis in CHINESE patients: a systemic review of reported cases. Orphanet Journal of Rare Diseases. 2018, (13). doi:10.1186/s13023-018-0968-2.
- ^ ACOG Committee Opinion #325: Update on Carrier Screening for Cystic Fibrosis. Obstet Gynecol 2005; 106:1465.
- ^ Stern, RC. The diagnosis of cystic fibrosis. N Engl J Med 1997; 336:487. PMID 9017943
- ^ Davis PB. Cystic fibrosis since 1938. American Journal of Respiratory and Critical Care Medicine. March 2006, 173 (5): 475–82. PMID 16126935. S2CID 1770759. doi:10.1164/rccm.200505-840OE.
- ^ MacKenzie T, Gifford AH, Sabadosa KA, Quinton HB, Knapp EA, Goss CH, Marshall BC. Longevity of patients with cystic fibrosis in 2000 to 2010 and beyond: survival analysis of the Cystic Fibrosis Foundation patient registry. Annals of Internal Medicine. August 2014, 161 (4): 233–41. PMC 4687404 . PMID 25133359. doi:10.7326/m13-0636.
- ^ Canadian Cystic Fibrosis Patient Data Registry Report (PDF). Canadian Cystic Fibrosis Foundation. 2007 [2010-03-14]. (原始内容 (PDF)存档于2010-07-15).
- ^ Annual Data Report 2016 Cystic Fibrosis Foundation Patient Registry (PDF): 4. [19 June 2018]. (原始内容 (PDF)存档于19 June 2018).
- ^ Medications. Cystic Fibrosis Canada. 2011. No. 10684-5100 RR0001. (原始内容存档于2011-09-04).
- ^ Habib, Al-Rahim R.; Kajbafzadeh, Majid; Desai, Sameer; Yang, Connie L.; Skolnik, Kate; Quon, Bradley S. A Systematic Review of the Clinical Efficacy and Safety of CFTR Modulators in Cystic Fibrosis. Scientific Reports. 2019-05-10, 9 (1): 7234. Bibcode:2019NatSR...9.7234H. ISSN 2045-2322. PMC 6510767 . PMID 31076617. doi:10.1038/s41598-019-43652-2.
- ^ Lopes-Pacheco, Miquéias. CFTR Modulators: The Changing Face of Cystic Fibrosis in the Era of Precision Medicine. Frontiers in Pharmacology. 2020, 10: 1662. ISSN 1663-9812. PMC 7046560 . PMID 32153386. doi:10.3389/fphar.2019.01662 .
- ^ Cystic Fibrosis Foundation. CFTR Modulator Therapies. [2023-12-23]. (原始内容存档于2024-07-03).
- ^ Yu H, Nasr SZ, Deretic V. Innate lung defenses and compromised Pseudomonas aeruginosa clearance in the malnourished mouse model of respiratory infections in cystic fibrosis. Infection and Immunity. April 2000, 68 (4): 2142–7. PMC 97396 . PMID 10722612. doi:10.1128/IAI.68.4.2142-2147.2000.
- ^ Ratjen F, Döring G. Cystic fibrosis. Lancet. February 2003, 361 (9358): 681–9. PMID 12606185. S2CID 24879334. doi:10.1016/S0140-6736(03)12567-6.
- ^ Rosenstein BJ, Zeitlin PL. Cystic fibrosis. Lancet. January 1998, 351 (9098): 277–82. PMID 9457113. S2CID 44627706. doi:10.1016/S0140-6736(97)09174-5 .
- ^ Moorcroft AJ, Dodd ME, Webb AK. Exercise limitations and training for patients with cystic fibrosis. Disability and Rehabilitation. 1998, 20 (6–7): 247–53. PMID 9637933. doi:10.3109/09638289809166735.