色素细胞
此条目需要补充更多来源。 (2017年2月5日) |
色素细胞,有时称为色素体,是两栖动物、鱼类、爬行动物、甲壳动物、头足纲动物中的一种含有生物色素的细胞。色素细胞是由胚胎中的神经嵴发展而来,对于产生皮肤色彩和眼睛色彩扮演重要角色。色素细胞依据白光下所呈现的颜色,可以分为黄色素细胞、红色素细胞、彩虹色素细胞、白色素细胞、黑色素细胞与蓝色素细胞。
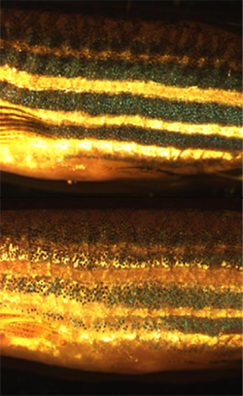
有些物种的色素细胞,能够透过色素位置的改变,以及反光结构方向的重新定位,达到快速改变色彩的目的。不同物种有不同的改变色彩方法,例如属于头足类的章鱼,是利用肌肉来控制结构复杂的色素细胞器官;而属于脊椎动物的变色龙,则利用细胞信号达到变色的目的。与变温动物不同,恒温动物中的鸟类和哺乳类只拥有一种类似色素细胞的黑素细胞,而变温动物身上与其作用相当的“载黑素细胞”,被科学家作为研究人类疾病以及开发药物的一种工具。
名词解释
编辑1819年,无脊椎动物身上带有色素的细胞,首先以“chromoforo”为名称,发表在意大利一科学期刊上[1]。之后则出现chromatophore一词,用来指脊椎动物与头足类从神经脊发展而来的一种带有色素的细胞。这个字来自希腊语“χρωμα”(khrōma、“色彩”)与“φορος”(phoros、“携带”)。Chromatocyte则专指哺乳类与鸟类中与色彩有关的细胞,目前为止只有黑素细胞在这些动物体内被发现。
现今的chromatophore则具有三种意义,可以指一种含有色素的动物细胞、植物与藻类细胞里一种又称为有色体(英语:chromoplast)的质粒、以及光合细菌里的一种胞器[2]。
分类
编辑一直到1960年代,科学家对于色素细胞的了解才足以对它们进行分类。这些分类一直持续到今天,即使近期的研究显示生物化学层面的研究对于了解这些细胞如何运作更为有用[3]。在生物化学上,生物色素能够分成生物色与构形色。生物色包括真色素,如类胡萝卜素和蝶酸,这些色素能吸收部分波长范围的可见光。而构形色并没有携带色素,却能够对细胞的色彩产生显著的影响,它们经由光线的扰乱和干涉等现象,能够产生彩虹般的色彩,甚至出现金色与银色。
虽然除基因突变之外(如白化症),所有的色素细胞皆拥有色素,但是并非带有色素的细胞都是色素细胞。例如拥有红色血红素的红血球,在胚胎发生时期的发育过程与色素细胞不同,而且红血球在成体时期是由骨髓中的造血干细胞制造,再由血液运送到身体各处。色素细胞则在成体时期已经出现在所要作用的位置(如真皮)。
黄色素细胞与红色素细胞
编辑色素细胞如果拥有大量带黄色的蝶酸色素称做黄色素细胞(英语:xanthophore),而其中若是带红色和橙色的类胡萝卜素过多,则称为红色素细胞(英语:erythrophore)[3]。有时候在同一个细胞中的囊泡里,蝶酸和类胡萝卜素会同时存在,也就是说,细胞整体的颜色实际上是受到黄色和红色的比例而定[4],因此辨识这些细胞的种类并没有确切的标准。
将三磷酸鸟苷转变成黄色的蝶酸是大多数色素细胞的特色,但是黄色素细胞拥有额外的生化路径,用以产生更多的黄色色素。而红色的类胡萝卜素是来自食物的代谢,并被输送到红色素细胞,这种现象的首次证明是以缺乏胡萝卜素的蟋蟀喂食青蛙而得到。食物中缺乏胡萝卜素,会使青蛙的红色素细胞缺少红色和橙色,并使外表由绿色转变成蓝色[5]。
彩虹色素细胞与白色素细胞
编辑彩虹色素细胞(英语:iridophore)也称为鸟色素细胞(英语:guanophore)。这种细胞的色素是由鸟嘌呤所构成,属于构形色,是利用结晶状平板来反射光线[6]。之所以在光照下能形成彩虹般的色彩,是因为光线经过层叠状的平板时产生的衍射现象,而构形的方向决定这些细胞在观察者眼中的色彩[7]。此外彩虹色素细胞也利用生物色作为色彩的过滤,经由廷得耳效应或是雷莱散射而产生鲜艳的蓝色或绿色[8]。某些鱼类拥有类似彩虹色素细胞的白色素细胞(英语:leucophore),这种细胞是利用结晶状的嘌呤来反射光线,并产生白色。
与黄色素细胞与红色素细胞的关系类似,彩虹色素细胞与白色素细胞并没有明确的分别。只是彩虹色素细胞通常产生的是彩虹或是金属般的光泽;白色素细胞则反射出白色色泽[8]。
黑色素细胞
编辑黑色素细胞(英语:melanocytes)含有一种黑色素,称为皮肤黑色素(英语:eumelanin),这种色素因为吸收光线而显现出黑色或是棕色,含有黑色素并分布在细胞中的囊泡,称为黑色体。酪氨酸经过一系列的化学反应就会生成皮肤黑色素,这是一种由二羟基吲哚、二羟基吲哚-2-羧酸,以及一些吡咯环组成的分子[9]。将各种原料合成黑色素的关键酵素是酪胺酸酶,当酵素出现缺陷时,黑色素将无法被合成,因此产生白化症。有些两栖类的皮肤黑色素会带有其他的色素,例如有一种蛙类(phyllomedusine)的黑色素细胞中被发现出奇特的深红色色素[10]。这种红色色素随后被发现是一种蝶酸的二聚物,它累积在皮肤黑色素周围。不过大多数的黑色素细胞仍然被皮肤黑色素所独占,只有少数物种拥有较复杂的内容。
人类只拥有一种色素细胞,也就是哺乳类身上与黑色素细胞相对应的黑素细胞,以此产生皮肤、毛发和眼睛的颜色。由于和其他细胞的鲜明差异,以及大量的存在,黑色素细胞是目前研究最透彻的色素细胞。不过黑色素细胞与黑素细胞还是有所不同,黑素细胞能够生产一种带有红色或黄色的色素,称为嗜铬黑色素或是假黑色素(英语:phaeomelanin)。
蓝色素细胞
编辑1995年,某些鳜鱼身上的鲜明蓝色被发现并非来自构形色,而是一种未知的生物色[8]。这种色素至少出现在两个物种的囊泡中,比起其他动物皆是构形色的蓝色相当不同。带有这些色素的细胞被称为蓝色素细胞(英语:cyanophore),这些不寻常的色素细胞可能也出现在其他的物种,如箭毒蛙和玻璃蛙身上的未知色素和鲜艳的色素细胞[11]。
发育过程
编辑色素细胞是在胚胎发生时期,由神经脊发展而来的其中一种细胞,首先发育为神经管边缘的两条细胞。之后这些细胞长距离的移动到各处(细胞迁移),使后来的皮肤、眼睛、耳朵与大脑等部位,都有色素细胞的存在。当细胞离开神经脊时,一方面行背外侧路线(英语:dorsolateral route),经由基底板进入外胚层;另一方面行腹内侧路线(英语:ventromedial route),穿过中胚叶节与神经管中间。不过视网膜上皮的黑色素细胞是其中的例外,它们并非由神经脊产生,而是在神经管外囊生成的视杯产生。
色素细胞的前驱细胞称为色素胚或色素母细胞(英语:chromatoblast)。色素胚的多能性,可以使它发展成各种类型的色素细胞。目前已知授精后第3天的斑马鱼胚胎中,就已经能够发现黑色素细胞、黄色素细胞与彩虹色素细胞。突变种的研究证明了一些转录因子,如kit、sox10与mitf,都是控制色素细胞分化的重要转录因子[12]。如果这些蛋白质被破坏,色素细胞将会部分或是完全消失,造成白化。
色素易位
编辑许多的物种能够经由改变色素细胞中色素的位置,来使外表的颜色改变,这种机制称为色素易位(英语:pigment translocation)或是生理色彩改变,目前以黑色素细胞的研究最透彻,因为黑色素是最明显的色素。在真皮较薄的物种中,黑色素细胞形成平面并覆盖广大的区域;而真皮较厚的物种,如爬虫类,黑色素细胞则与其他种类的色素细胞聚集形成立体状,称为真皮色素细胞单位(英语:dermal chromatophore units,简写:DCU)。这些单位以黄色素细胞或是红色素细胞作为最外层,其次是彩虹色素细胞,最后是网状的黑色素细胞层,且这些网状的空隙能够通过彩虹色素细胞[13]。
以上两种真皮黑色素细胞的组成类型对生理色彩改变而言皆相当重要,平面的真皮黑色素细胞通常覆盖着其他种类的色素细胞。当黑色素分散在整个细胞中时,动物的外观为黑色;当这些黑色素集中到细胞中央时,其他色素细胞的色彩就会在光照下被显现出来。立体的真皮色素细胞单位也有类似现象,当黑色素集中时,由于彩虹色素细胞的色彩在经过黄色素细胞的时候被扰乱,使动物的外观为绿色;当黑色素分散的时候,光线不再被扰乱,因此形成黑色的外观。其他带生物色素的色素细胞也有色素易位的能力,拥有许多种类型色素细胞的动物,能够在外皮产生显眼的色彩排列[14][15]。
色素易位的调控机制也已经被深入研究,尤其是关于两栖类和真骨鱼类的研究[16][8]。这些机制能够以激素、神经传导物质或是两者共同来调控。正肾上腺素能够与黑色素细胞膜上的肾上腺素受体结合,并控制色素易位[17]。作为色素易位初级讯号的激素包括了黑色皮质素、褪黑激素与黑色素凝集激素(英语简写:MCH),而这三种激素大多数是分别由脑垂体、松果体与下丘脑制造,此外也能以皮肤细胞的旁分泌方式生产。这些激素刺激黑色素细胞表面的G蛋白耦合性受体(英语:G-protein coupled receptors),之后讯号辗转进入细胞内部。黑色皮质素能使色素分散,而褪黑激素与黑色素凝集激素则使色素集中[18]。
许多鱼类与蛙类的黑色皮质素、褪黑激素与黑色素凝集激素的受体已经被辨识出来[19][20],包括它们的同源物黑色皮质素受体1(英语简写:MC1R)[21],这是一种人类身上用来调控肤色与发色的黑色皮质素受体[22]。环磷酸腺苷(英语简写:cAMP)在细胞内作为色素易位的二级讯号,能够影响其他的蛋白质,并促使分子马达沿着微管与微丝移动包含色素的囊泡,不过详细机制尚未明了[23][24][25]。
背景适应
编辑大多数的鱼类、两栖类和爬虫类经由能力有限的生理色彩改变,对环境的变化做反应。这种类型的伪装称为“背景适应”,会使动物外表会产生轻微的变黑或变淡,通常用来对周遭环境进行精确的拟态。研究证明这种背景适应必须依赖视觉,也就是这些动物必须能够看见周围的景物[26]。黑色素细胞中的黑色素易位是色彩改变的最主要原因[18]。某些动物,如变色龙与变色蜥,拥有高度发展的背景适应反应,能够快速的改变多种颜色,它们会因为温度、情绪、压力和社会信号而改变色彩,而不只是简单的对环境做拟态。
头足纲
编辑头足纲里的蛸亚纲能够利用复杂的多种细胞组合而成的器官,进行快速的色彩变换,这是许多拥有鲜艳色彩的乌贼、章鱼和墨鱼的主要特色。每一个色素细胞单位含有一个色素细胞,以及许多肌肉、神经、 神经胶细胞与神经鞘细胞[27]。在色素细胞里面,色素的颗粒被包围在有弹性的囊中,称为细胞弹性囊(英语:cytoelastic sacculus)。经由肌肉的控制,改变这些囊的形状或大小,使细胞的透明度或是反射能力改变,并造成色彩变化。这种机制与鱼类、两栖类和爬虫类有所不同,是透过囊的变形来改变色彩,而不是色素的传递和移动。
章鱼能够以色彩结构的快速变化来控制色素细胞,使外表显现出复杂的、波纹般的色彩。这些控制色素细胞的神经被认为位在大脑中,且与它们所控制的色素细胞具有相似的次序。也就是说,色素细胞的色彩变化规律与神经细胞的动作电位规律吻合。这样便能够解释为何神经元在正在被活化的同时,色彩也会出现波纹状的变化[28]。与变色龙一样,头足纲会利用生理色彩改变进行社会互动,也有背景适应的能力,能够使自己的花纹与颜色和环境做出准确的适应。
人工应用
编辑色素细胞被用来进行许多基础研究,以对这些细胞有更深入的了解。例如斑马鱼的幼体,能够用来研究成体斑马鱼精确的产生横向条纹时,色素细胞之间的安排和连结[29],所以斑马鱼是适合用来了解演化发育生物学领域中,动物花纹生成的动物模型。色素细胞也能够当作研究人类疾病与症状的模型,如黑色素细胞瘤与白化症。此外最近的研究发现黄金斑马鱼品系中,与黑色素细胞特化有关的基因Slc24a5,在人体中也有,且对于皮肤的颜色有很大的关联性[30]。
变温动物透过视觉来感应环境的光线,并进行背景适应,因此色素细胞也被用来当作判别变温动物眼盲的生物标志[26]。由于人体中参与色素讯息传递的受器与食欲的抑制和日光浴的效果有关,使它们成为制药公司的宠儿[21]。也因此制药公司利用非洲爪蟾的黑色素细胞,发展出用来快速辨识化合物是否具有生物活性的生物检定法[31]。其他的科学家则发展出利用黑色素细胞作为生物感测器的技术[32],且基于百日咳毒素阻碍鱼类黑色素细胞中色素扩张的现象,发展出快速检测是否感染百日咳的技术[33]。色素细胞也具有潜在的军事用途,也就是光学迷彩或是主动伪装技术[34]。
参看
编辑参考文献
编辑- ^ Sangiovanni G. Descrizione di un particolare sistema di organi cromoforo espansivo-dermoideo e dei fenomeni che esso produce, scoperto nei molluschi cefaloso. G. Enciclopedico Napoli. 1819; 9:1-13.
- ^ H.G Hale, J.P. Margham, V. A. Saunders 猫头鹰编译组(译) 生物学辞典 猫头鹰出版社 ISBN 986-7879-90-2
- ^ 3.0 3.1 Bagnara JT. Cytology and cytophysiology of non-melanophore pigment cells. Int Rev Cytol. 1966; 20:173-205. PMID 5337298
- ^ Matsumoto J. Studies on fine structure and cytochemical properties of erythrophores in swordtail, Xiphophorus helleri. J Cell Biol. 1965; 27:493-504. PMID 5885426
- ^ Bagnara JT. Comparative Anatomy and Physiology of Pigment Cells in Nonmammalian Tissues in The Pigmentary System: Physiology and Pathophysiology, 牛津大学出版社, 1998. ISBN 0-19-509861-7
- ^ Taylor JD. The effects of intermedin on the ultrastructure of amphibian iridophores. Gen Comp Endocrinol. 1969; 12:405-16. PMID 5769930
- ^ Morrison RL. A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores. Pigment Cell Res. 1995; 8:28-36. PMID 7792252
- ^ 8.0 8.1 8.2 8.3 Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell Res. 2000; 13:300-19. PMID 11041206
- ^ Ito S & Wakamatsu K. Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review. Pigment Cell Res. 2003; 16:523-31. PMID 12950732
- ^ Bagnara JT et al. Color changes, unusual melanosomes, and a new pigment from leaf frogs. Science. 1973; 182:1034-5. PMID 4748673
- ^ Schwalm PA et al. Infrared reflectance in leaf-sitting neotropical frogs. Science. 1977; 196:1225-7. PMID 860137
- ^ Kelsh RN et al. Genetic analysis of melanophore development in zebrafish embryos.] Dev Biol. 2000; 225:277-93. PMID 10985850
- ^ Bagnara JT et al. The dermal chromatophore unit. J Cell Biol. 1968; 38:67-79. PMID 5691979 文件档 (页面存档备份,存于互联网档案馆) (pdf).
- ^ Palazzo RE et al. Rearrangements of pterinosomes and cytoskeleton accompanying pigment dispersion in goldfish xanthophores. Cell Motil Cytoskeleton. 1989; 13:9-20. PMID 2543509
- ^ Porras MG et al. Corazonin promotes tegumentary pigment migration in the crayfish Procambarus clarkii. Peptides. 2003; 24:1581-9. PMID 14706537
- ^ Deacon SW et al. Dynactin is required for bidirectional organelle transport.] J Cell Biol. 2003; 160:297-301. PMID 12551954 文件档 (页面存档备份,存于互联网档案馆)
- ^ Aspengren S et al. Noradrenaline- and melatonin-mediated regulation of pigment aggregation in fish melanophores. Pigment Cell Res. 2003; 16:59-64. PMID 12519126
- ^ 18.0 18.1 Logan DW et al. Regulation of pigmentation in zebrafish melanophores. Pigment Cell Res. 2006; 19:206-13. PMID 16704454
- ^ Logan DW et al. Sequence characterization of teleost fish melanocortin receptors. Ann N Y Acad Sci. 2003; 994:319-30. PMID 12851332
- ^ Sugden D et al. Melatonin, melatonin receptors and melanophores: a moving story. Pigment Cell Res. 2004; 17:454-60. PMID 15357831
- ^ 21.0 21.1 Logan DW et al. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. Genomics. 2003; 81:184-91. PMID 12620396
- ^ Valverde P et al. Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans. Nat Genet. 1995; 11:328-30. PMID 7581459
- ^ Snider J et al. Intracellular actin-based transport: how far you go depends on how often you switch. Proc Natl Acad Sci USA. 2004; 101:13204-9. PMID 15331778 文件档 (页面存档备份,存于互联网档案馆)
- ^ Rodionov VI et al. Functional coordination of microtubule-based and actin-based motility in melanophores. Curr Biol. 1998; 8:165-8. PMID 9443917 文件档 (页面存档备份,存于互联网档案馆)
- ^ Rodionov VI et al. Protein kinase A, which regulates intracellular transport, forms complexes with molecular motors on organelles. Curr Biol. 2002; 14:1877-81. PMID 15498498 文件档 (页面存档备份,存于互联网档案馆)
- ^ 26.0 26.1 Neuhauss SC. Behavioral genetic approaches to visual system development and function in zebrafish. J Neurobiol. 2003; 54:148-60. PMID 12486702. 文件档[永久失效链接] (pdf).
- ^ Cloney RA. & Florey E. Ultrastructure of cephalopod chromatophore organs. Z Zellforsch Mikrosk Anat. 1968; 89:250-280. PMID 5700268
- ^ Demski LS. Chromatophore systems in teleosts and cephalopods: a levels oriented analysis of convergent systems. Brain Behav Evol. 1992; 40:141-56. PMID 1422807
- ^ Kelsh RN. Genetics and evolution of pigment patterns in fish. Pigment Cell Res. 2004; 17:326-36. PMID 15250934
- ^ Lamason RL et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science. 2005; 310:1782-6. PMID 16357253
- ^ Jayawickreme CK et al. Use of a cell-based, lawn format assay to rapidly screen a 442,368 bead-based peptide library. J Pharmacol Toxicol Methods. 1999; 42:189-97. PMID 11033434
- ^ Andersson TP et al. Frog melanophores cultured on fluorescent microbeads: biomimic-based biosensing. Biosens Bioelectron. 2005; 21:111-20. PMID 15967358
- ^ Karlsson JO et al. The melanophore aggregating response of isolated fish scales: a very rapid and sensitive diagnosis of whooping cough. FEMS Microbiol Lett. 1991; 66:169-75. PMID 1936946
- ^ Lee I. Nanotubes for noisy signal processing: Adaptive Camouflage PhD Thesis. 2005; 南加州大学. Retrieved June 2006 互联网档案馆的存档,存档日期2007-09-27. (pdf).
外部链接
编辑- (英文)大自然的调色板 - 动物的色彩如何产生PDF
- (英文)头足类背景适应过程影片 (页面存档备份,存于互联网档案馆)
- (英文)乌贼改变花纹过程影片
- (英文)Tree of Life: 头足纲的色素细胞